
2025年9月12日,清华大学药学院杜娟娟团队与生命科学学院李丕龙团队在Journal of the American Chemical Society(JACS)上合作发表了题为“Immunoglobulin-Directed Phase Separation for Cell-Specific Modulation of Receptor Signaling”的研究论文。团队构建了一种免疫球蛋白引导的相分离系统(IgPS),利用抗体与多价肽段的相互作用在细胞膜上驱动特定受体形成凝聚体,从而实现受体的精准聚集与信号放大。在靶向CXCR4和DR5的应用中,IgPS能够特异性诱导CXCR4⁺/DR5⁺肿瘤细胞凋亡;在小鼠肿瘤模型中,该系统亦显著抑制肿瘤生长。该研究不仅借助相分离的独特生物物理特性,为膜受体的空间调控提供了全新工具,也为蛋白质药物的精准设计和肿瘤靶向治疗开辟了新路径,展示了相分离策略在生命科学与精准医学中的广阔应用前景。
01研究背景
蛋白质药物因其高特异性和在调控生物过程中发挥的关键作用,已成为治疗多种疾病的重要手段。然而,在系统性给药时,这类药物常因作用于非靶组织而产生副作用。如何实现蛋白质药物的精准靶向,是提升疗效与安全性的核心挑战。
细胞膜上的受体是信号传导的枢纽,但传统抗体或小分子药物往往难以精确调控受体的空间分布和聚集状态。近年来,研究发现液-液相分离(LLPS)可以将蛋白质等生物分子局部浓缩,形成无膜的凝聚体,既延长受体在膜上的驻留时间,又提高局部信号蛋白浓度,从而显著放大信号。这为精准调控膜受体提供了新思路。
02研究内容
研究团队建立了一种免疫球蛋白引导的相分离系统(IgPS)。他们首先设计了Fc突变体,以避免体内内源性抗体的干扰,并通过噬菌体展示筛选出特异性结合的肽段AIP1。随后,将不同重复数的AIP1单元与荧光蛋白mCherry融合表达,生成融合蛋白mCherry-AIP1n。当这些融合蛋白与Fc突变体混合时,形成液滴状凝聚体,并表现出动态分子交换特性。实验结果表明,凝聚体的形成依赖于突变Fc与肽段的多价相互作用;低价肽或野生型Fc均无法诱导液滴形成(图1)。
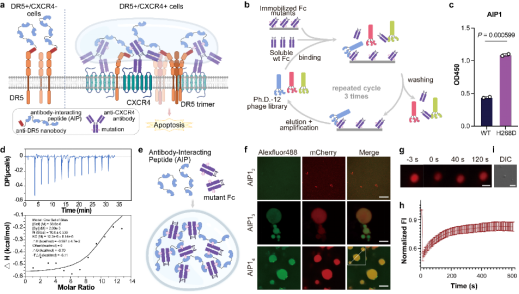
图1 工程化相分离系统
研究团队构建了DR5×CXCR4靶向的IgPS系统,并验证了其在细胞膜上诱导液滴状凝聚体形成、驱动CXCR4与DR5共聚集的能力。在体外实验中,该系统能够特异性激活DR5+/CXCR4+细胞的凋亡。将不同价态的靶向DR5的DNB-AIP1n与靶向CXCR4的CNB-mutFc组合使用时,DNB-AIP13-5能够有效诱导SJSA-1细胞凋亡,同时在Western blot中检测到caspase-8、caspase-3和PARP的裂解。相比之下,该系统在DR5⁺/CXCR4⁻的HepG2细胞中未表现出明显作用(图2d)。进一步的体内实验表明,DNB-AIP14与CNB-mutFc联合给药后,DNB-AIP14在肿瘤部位显著富集,并在NOD/SCID小鼠的SJSA-1异种移植瘤模型中表现出强效的抑瘤作用。与PBS对照组相比,联合治疗组的肿瘤在给药三天后即开始缩小,且在实验结束时平均体积明显低于对照组,而DNB-AIP14单独给药仅产生轻微抑制效果。整体结果表明,DNB-AIP14/CNB-mutFc通过特异性诱导DR5+/CXCR4+细胞凋亡,有效抑制肿瘤生长(图2)。
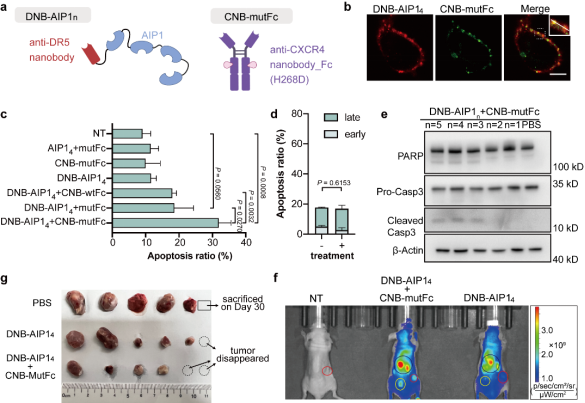
图2 DNB-AIP1n/CNB-mutFc诱导CXCR4⁺/DR5⁺ SJSA-1细胞凋亡
03研究意义与展望
这项研究开发了一种抗体引导的相分离(IgPS)策略,实现了对细胞表面受体的精确聚集与信号调控。该系统兼具抗体的高特异性、优异稳定性、延长循环时间以及低免疫原性,同时肽-抗体突变体的特异性相互作用可有效降低体内内源抗体的干扰,使其在体内应用更加可靠。此外,IgPS系统通过多价作用实现对受体聚集状态的细胞特异性调控,为精确调节受体功能提供了新的手段。展望未来,该系统有望拓展至更多类型的细胞表面受体,实现细胞特异性的受体激动或抑制,为精准调控细胞信号传导和开发新型靶向治疗提供潜在策略,同时也为解析复杂微环境中受体动态调控机制的基础研究提供有力工具。
04致谢
清华大学药学院杜娟娟副教授与生命科学学院李丕龙副教授为本论文的通讯作者,药学院2019级博士生任伟帅、2020级博士生郑培源(现为清华大学药学院博士后)、2024级博士生周子婷为论文的共同第一作者。此外,已毕业博士生周敏(李丕龙课题组)、吴孟玲(杜娟娟课题组)等也为该研究作出了重要贡献。清华大学实验仪器平台曹慧珍老师、王瑾瑜老师、张晖老师为该研究提供了极大帮助。该研究得到了清华大学笃实计划的资助。
05参考文献
Schardt, J. S.; Jhajj, H. S.; O'Meara, R. L.; Lwo, T. S.; Smith, M. D.; Tessier, P. M. Agonist antibody discovery: Experimental, computational, and rational engineering approaches. Drug Discov Today 2022, 27 (1), 31-48.
Case, L. B.; Zhang, X.; Ditlev, J. A.; Rosen, M. K. Stoichiometry controls activity of phase-separated clusters of actin signaling proteins. Science 2019, 363 (6431), 1093-1097.
Litschel, T.; Kelley, C. F.; Cheng, X.; Babl, L.; Mizuno, N.; Case, L. B.; Schwille, P. Membrane-induced 2D phase separation of the focal adhesion protein talin. Nature Communications 2024, 15 (1), 498006.科学家小档案

杜娟娟 清华大学药学院
杜娟娟,清华大学药学院副教授,博士生导师,国家级海外高层次人才项目入选者。2007年本科毕业于北京大学化学与分子工程学院,2012年于美国加州大学洛杉矶分校获得化学工程博士学位,随后在斯克里普斯研究所(Scripps Research)进行博士后研究。2016年全职加入清华大学药学院从事技术驱动的生物药创新研究。团队面向目前生物药研究中的主要挑战,聚焦在细胞表面蛋白的功能、聚集态和内吞性质调控,通过整合生物偶联、蛋白工程、纳米技术等前沿技术发展创新型的药物平台。近年来,团队发展了具有组织特异性的胞内大分子药物递送系统、针对多次跨膜蛋白的“配体锚定单抗平台”、针对细胞表面蛋白聚集态调控的“抗体引导的相分离系统”等药物平台,推动生物药的源头创新。杜娟娟博士的研究结果发表于Nat Chem Bio、Nat Nanotech等高水平期刊上共三十余篇,申请专利十余项,获得国家自然基金、科技部重点研发计划等项目资助,并与多家国内外药企开展合作研究。