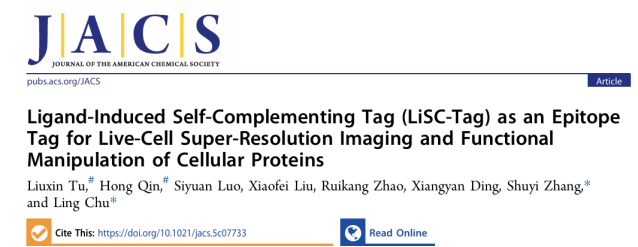
2025年9月18日,清华大学药学院储凌课题组在Journal of the American Chemical Society期刊发表了题为“Ligand-induced Self-Complementing tag (LiSC-tag) as an epitope tag for live-cell super-resolution imaging and functional manipulation of cellular proteins”的研究论文。本研究基于分裂FKBP F36V蛋白开发了一种新型表位标签LiSC-tag,实现了在活细胞中的超分辨成像,并可用于内源蛋白标记与常规成像,同时拓展到蛋白定位调控和靶向降解,为蛋白质动态研究与功能解析提供了全新的技术工具。
1 研究背景
超分辨显微技术的出现,使科研人员能够在纳米级别上观察活细胞中的生物学过程。然而,成像标签始终是限制该技术进一步发展的关键因素。传统的方法例如抗体染色,由于抗体尺寸较大(10–15 nm),往往会引入明显的空间偏差;荧光蛋白(FPs)和自标记标签(Halo、SNAP等)虽然能在一定程度上减少偏差,但其分子量依然有20–30 kDa,仍可能影响蛋白的结构、功能与定位,同时有些标签还存在光稳定性不足的问题。相比之下,体积小巧的表位标签(通常仅十几个氨基酸)因对蛋白功能干扰较小而备受青睐,被视为活细胞超分辨成像的理想工具。然而,现有表位标签仍存在特异性不足、信噪比偏低、细胞通透性差以及光稳定性有限等问题,从而限制了其在活细胞研究中的广泛应用。
为突破这一技术瓶颈,清华大学药学院储凌、张数一课题组合作开发了LiSC-tag。这一全新策略将表位标签的紧凑特性与小分子染料的高亮度和高光稳定性结合起来,从根本上解决了传统表位标签信号弱、背景高的难题,为活细胞蛋白质成像开辟了新的可能。
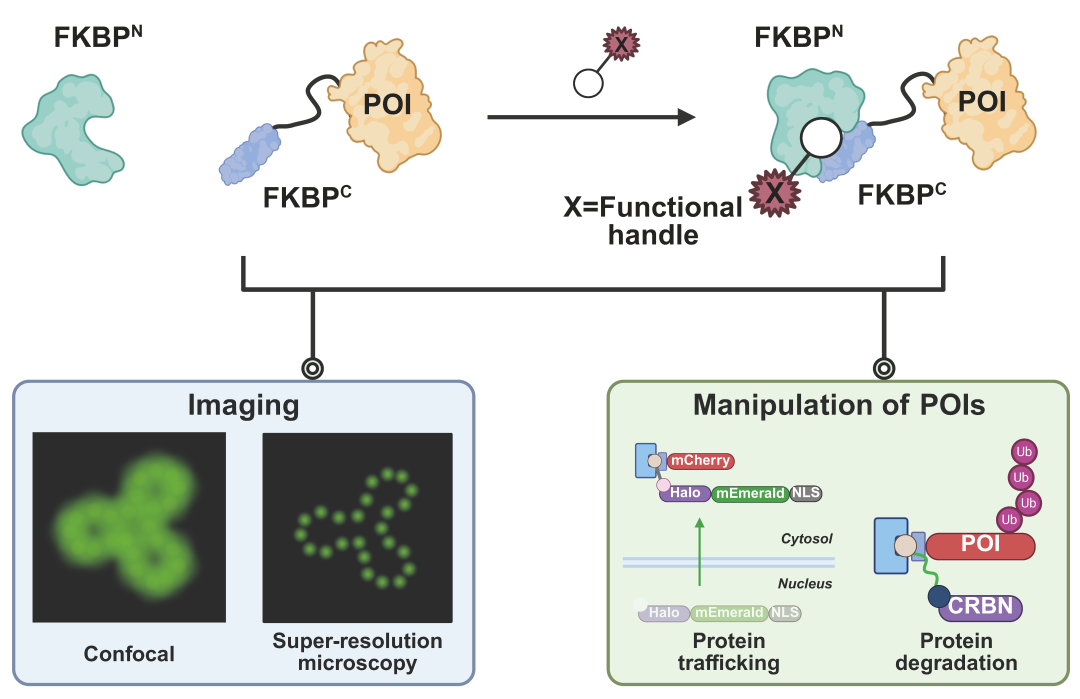
图1 LiSC-tag策略示意图
2 研究内容
研究团队首先从分裂FKBP F36V蛋白出发,设计了配体依赖的自互补系统。研究人员引入了噬菌体辅助非连续进化(PANCE)方法,通过双重正交选择同时提升分裂片段的可溶性表达与配体依赖的三元复合物形成效率(图2 B)。在此基础上,团队结合结构分析进行关键氨基酸突变(图2 F, G),并通过切割位点的系统优化(图2 H)进一步增强了大小片段在配体诱导下的互补能力。经过这一系列“三重改造”,最终获得的LiSC-tag在可溶性表达及配体依赖的自互补效率方面均得到显著提升,从而为其在活细胞成像中的应用奠定了基础。
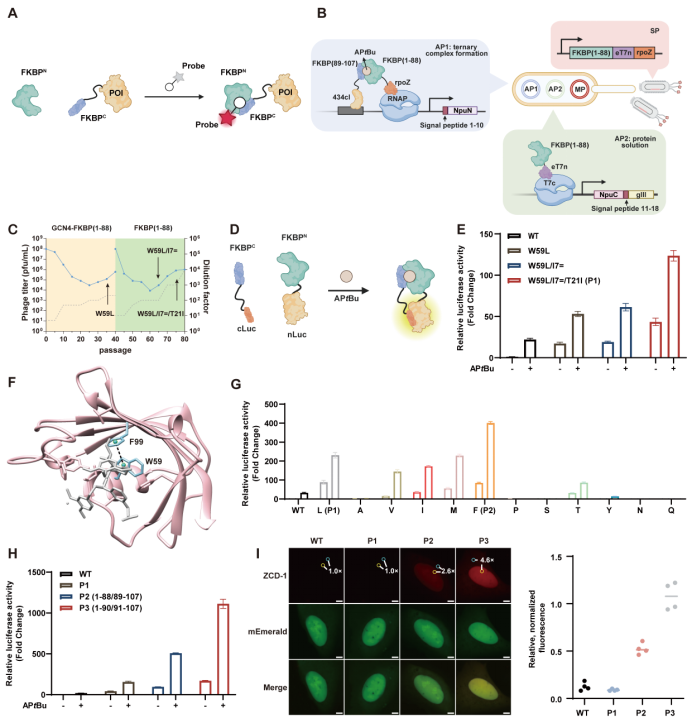
图2. LiSC-tag的进化以及优化
在功能验证中,研究人员将FKBPC小肽分别融合到Lifeact、LAMP1、mEmerald-NLS、Nup62、KRAS、Sec61β等多种蛋白上,结果均准确再现了这些蛋白在细胞骨架、溶酶体、细胞核、核孔、细胞膜及内质网等亚细胞结构中的分布模式(图3 A)。进一步实验中,团队还尝试了不同颜色的小分子探针(如ZCD-7与ZCD-8),发现均可实现清晰的荧光标记(图3 B),表明LiSC-tag对不同颜色探针均具有良好的兼容性,为后续开展多色成像研究奠定了基础。
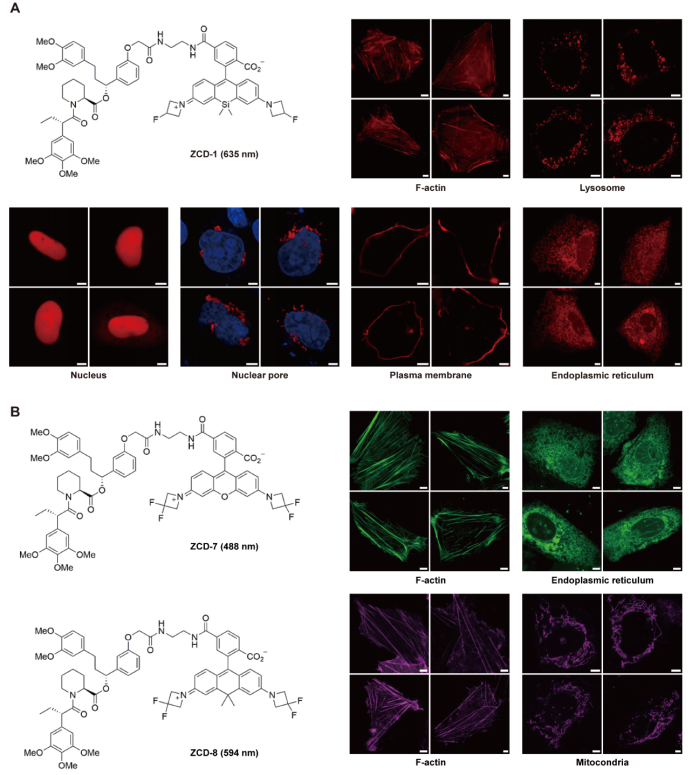
图3 LiSC-tag在多种亚细胞结构及多色成像中的应用
在性能评估中,研究团队将LiSC-tag与现有的多种标记体系进行了系统比较。与split GFP和split sfCherry2相比,LiSC-tag展现出显著优势,其荧光亮度分别提升了2.6倍和4.0倍(图4 A, B),光漂白半衰期较split GFP延长了2.7倍(图4 C),证明其在活细胞成像中具有更高的亮度和更强的光稳定性。进一步与Halo-tag和SNAP-tag的比较结果显示,LiSC-tag的亮度接近Halo-tag,而远高于SNAP-tag(图4 D)。这些数据表明,LiSC-tag在保持小分子量的同时,兼具与自标记蛋白标签相当的光物理性能,成功突破了传统小型标签性能不足的限制。
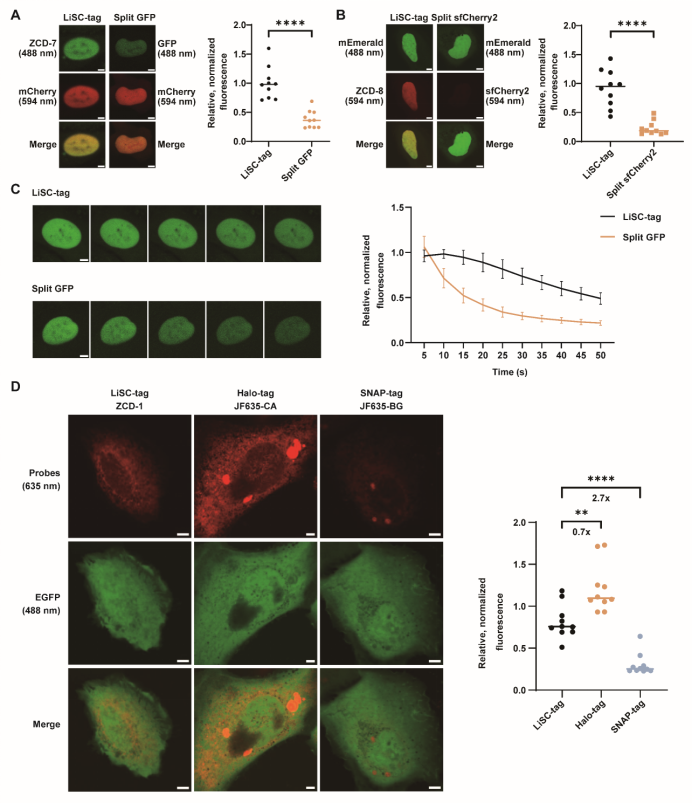
图4 LiSC-tag与其他标记方法的比较
在超分辨显微实验中,LiSC-tag展现出极强的适用性。在活细胞STED成像中,研究人员成功获得了分辨率达60-70 nm的内质网图像(图5 A),并在长时间拍摄中依然保持了良好的抗光漂白性能(图5 B)。在双色STED成像实验中,LiSC-tag与Halo-tag联合标记的微丝与内质网、或内质网与线粒体均被清晰区分,体现了其与其他标签的高度兼容性(图5 C)。进一步在STORM成像中,LiSC-tag标记的内质网与中间丝均实现了约50 nm的分辨率重建,结构细节清晰可辨(图5 D)。最后,在活细胞SIM成像实验中,LiSC-tag 同样表现出稳定的荧光性能,能够精准描绘微丝与微管的骨架分布。这些结果共同证明,LiSC-tag可广泛应用于多种超分辨技术,为活细胞高分辨率成像提供了强有力的工具平台。
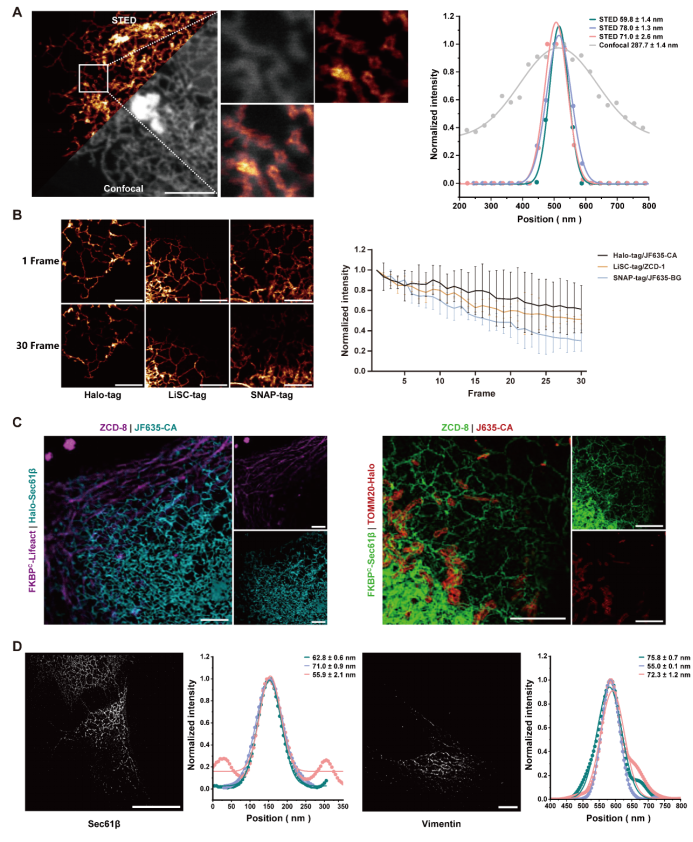
图5 LiSC-tag在超分辨成像中的应用
在内源蛋白标记实验中,研究团队利用CRISPR基因编辑技术,将FKBPC小肽敲入到Actin、Tubulin、Clathrin和RNA结合蛋白FUS等内源基因中,并在活细胞中成功观察到其天然分布模式(图6 A-C)。相比过表达系统,内源标记的蛋白在结构保持与生理功能上更加真实。例如,在FUS蛋白的成像实验中,过表达导致其核内液滴数量与大小异常,而内源性标记则如实呈现了其自然状态(图6 B)。这充分说明,LiSC-tag不仅体积小、易于敲入,还能够在不扰乱蛋白功能的前提下,实现对内源性蛋白的精准成像。
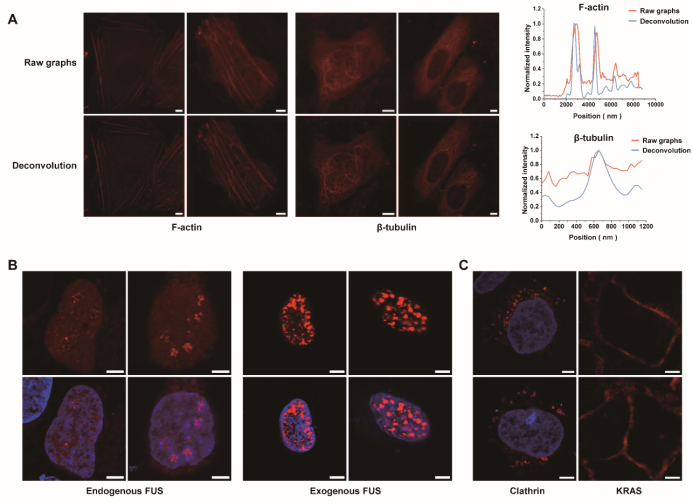
图6 LiSC-tag对内源蛋白的标记与成像
更值得关注的是,LiSC-tag在蛋白功能操控方面同样展现出独特潜力。研究团队通过设计带有化学连接基团的配体,实现了蛋白在细胞核与细胞质之间的可控运输(图7A, B),从而能够精确调节蛋白的亚细胞定位。此外,LiSC-tag还可以与小分子降解剂dTAG-13联合使用,用于特异性降解KRAS等关键蛋白。实验结果表明,当KRAS融合FKBPC小肽后,经dTAG-13处理数小时即可观察到其蛋白水平显著下降,且该过程依赖于泛素-蛋白酶体途径完成(图7 C-F)。以上发现说明,LiSC-tag不仅是一个高效的成像工具,更是一种能够实现蛋白动态操控的多功能平台。
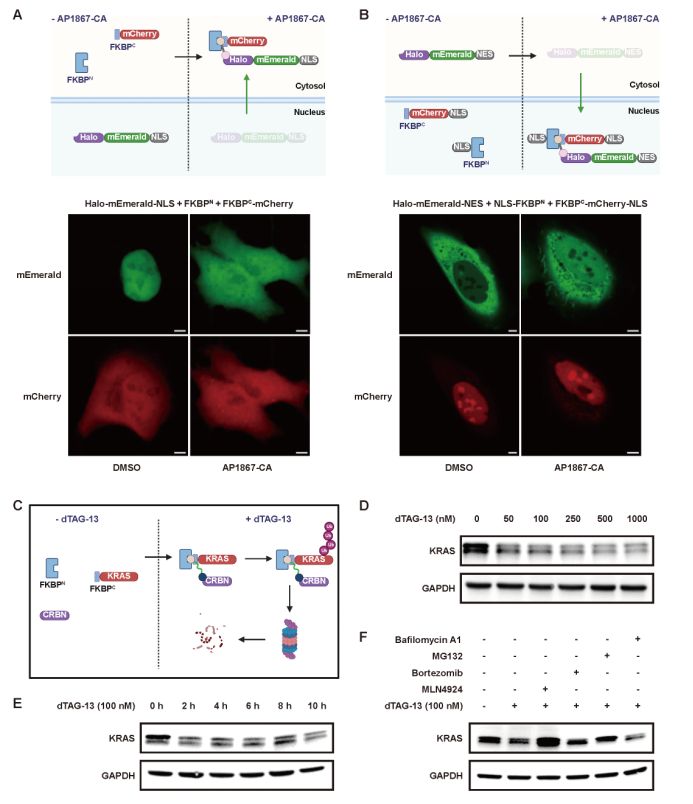
图7 LiSC-tag在蛋白运输与靶向降解中的应用
综上所述,本研究表明LiSC-tag在共聚焦及多种超分辨显微成像模式中均表现出优异性能,并在内源蛋白标记和蛋白功能操控方面展现出独特优势,不仅克服了长期困扰多肽标签的效率与特异性难题,也为蛋白研究开辟了新的可能性。
3 致谢
清华大学药学院储凌副教授、张数一副教授为本文的共同通讯作者。储凌课题组2019级博士生涂柳欣与张数一课题组2022级博士生秦红为本文的共同第一作者。储凌课题组博士生罗思远、刘晓菲,药学院李寅青老师及博士生富晶晶、黄明磊,以及哈尔滨工业大学丁相妍老师在实验过程中给予了重要支持。
科学家小档案

储凌 清华大学药学院
储凌博士2012年本科毕业于中国科学技术大学化学系,2017年于斯克里普斯研究所获得化学博士学位。2017至2021年在耶鲁大学从事博士后研究,2021年3月起加入清华大学药学院,任助理教授、副教授。储凌博士期间从事有机化学研究,发展了首例基于动力学拆分的钯催化碳氢键活化反应,随后在博士后阶段分别从事化学生物学与药物化学研究,期间他发展了基于小分子探针的多色、长时间、超高分辨活细胞荧光成像技术,解决了在超分辨细胞器成像中光漂白的问题。他还设计并合成了首个能够降解致癌蛋白KRAS的蛋白降解靶向嵌合体 (PROTAC),为治疗KRAS突变的癌症提供了新的思路。储凌博士目前的研究方向有:1) 光稳定的蛋白荧光成像方法;2)基于小肽的蛋白标记新方法; 3) 近红外光启动、时空可控的生物技术的开发; 4) 基于新靶点、新机制的药物化学研究。课题组主页:chu-lab.org。储凌课题组长期招聘有机化学、化学生物学及有生物学背景的博士后,有意向者请邮件关系:lingchu@mail.tsinghua.edu.cn。

张数一 清华大学药学院
张数一,清华大学药学院副教授,博士生导师,清华大学合成与系统生物学研究中心PI,分子肿瘤学全国重点实验室PI,入选国家高层次人才计划青年项目。本科毕业于清华大学生物科学与技术系;博士毕业于宾夕法尼亚州立大学;之后在美国麻省理工学院进行博士后研究;2019年加入清华大学药学院。主持国家自然科学基金联合基金重点项目,国家自然科学基金面上项目,国家科技重大专项“重大新药创制”课题,国家重点研发计划课题等。担任中国生物工程学会合成生物学分会青年工作组委员,中国医药生物技术协会合成生物技术分会委员,中国生物信息学会(筹)计算合成生物学专业委员会委员等。张数一课题组长期致力于交叉融合还原论和重构论研究思路,聚焦研究生命系统序列-功能映射关系规律,以及可预测合成设计原理,推动生物学从经验科学向理性设计转变,为应对人类面临的健康、环境等重大挑战提供创新解决方案。