
2025年8月30日,清华大学药学院储凌、秦为课题组在《Nature Communications》期刊发表了题为“Silicon-rhodamine-enabled Identification for Near-Infrared Light Controlled Proximity Labeling In Vitro and In Vivo”的研究论文。本研究开发了一种基于硅罗丹明(SiR)的近红外光控邻近标记技术(SeeID),通过巧妙整合硅罗丹明的荧光与光催化特性,成功连接了荧光成像与邻近标记技术,为活细胞与体内动态蛋白质互作组研究提供了全新工具。
研究背景
在现代生命科学研究中,蛋白质的动态变化与相互作用是理解细胞功能、疾病机制的核心。荧光成像技术虽能以超高时空分辨率追踪蛋白质定位与动态,却无法揭示成像背后的分子互作网络;传统邻近标记技术(PL)虽能通过质谱分析捕获蛋白质互作组,却只能提供单时间点的 “快照”,且难以实现实时动态追踪。这一技术鸿沟严重制约了对复杂生物学过程的深入解析。为此,清华药学院储凌、秦为课题组合作开发了一种基于硅罗丹明(SiR)的近红外光控邻近标记技术(SeeID),成功填补了这一空白,实现了活细胞与体内环境下 “成像追踪 - 互作分析” 的一体化研究。
研究内容
SeeID 技术的核心创新在于对硅罗丹明(SiR)分子功能的双重开发 —— 将其同时作为荧光团与光催化剂,结合 Halo-Tag 等自标记标签,构建起近红外光调控的邻近标记体系。SiR 分子具有独特的荧光特性,其在水溶液或疏水环境中以非荧光的螺环形式存在,而与 Halo-Tag 共价结合后会转变为荧光的两性离子形式,这一 “荧光开关” 特性确保了标记的高空间特异性,可有效减少非特异性背景。同时,在 660 nm 近红外光照射下,结合态的 SiR 能通过能量转移(EnT)途径生成单线态氧,氧化邻近蛋白质的组氨酸残基,进而与生物素化或炔基化探针结合,实现对目标蛋白(POI)邻近蛋白的共价标记,后续通过质谱(LC-MS/MS)即可解析互作组信息。
为验证 SeeID 的性能,研究团队首先开展了体外与细胞内的基准测试(图1)。在体外实验中,10 μM SiR-CA(硅罗丹明氯代烷衍生物)与 Halo 蛋白形成共价复合物后,经 660 nm LED 照射,可高效介导生物素化探针(如 BA)或炔基探针(如 3-EA)对邻近蛋白的标记;通过单线态氧传感器 SOSG 检测及维生素 C(NaVc)淬灭实验,证实了单线态氧在标记过程中的核心作用。更重要的是,SiR 的荧光特性使其仅在结合 Halo 蛋白时才高效生成单线态氧,而非荧光光敏剂亚甲蓝(MB)则会无差别标记蛋白,凸显了 SeeID 的低背景优势。
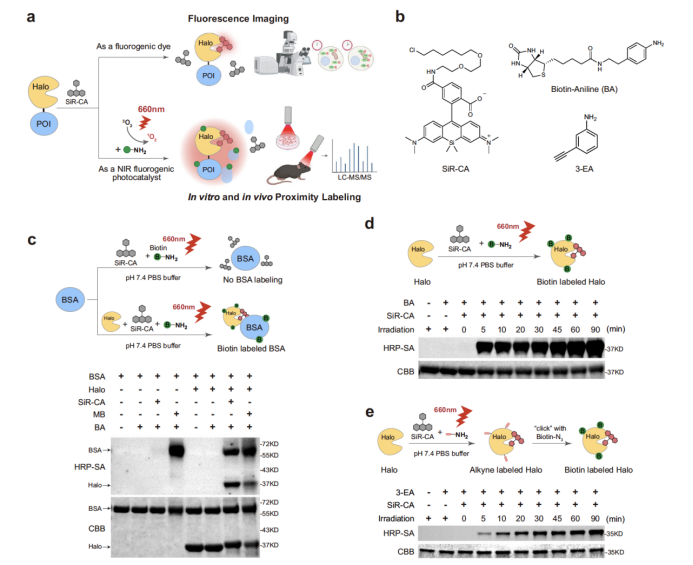
图1. SeeID的体外验证
在细胞水平,研究团队优化了标记条件,筛选出标记效率最高的炔基探针 3-EA,并对细胞核(NLS)、内质网(Sec61β)、线粒体(TOMM20)、溶酶体(LAMP1)等多种细胞器的特异性蛋白质组进行表征(图2)。共聚焦成像显示,SeeID 标记信号与细胞器标志物的皮尔逊相关系数(PCC)达 0.83-0.94,表明其极高的空间特异性;Western blot 与质谱分析进一步证实,不同细胞器的标记蛋白呈现出显著的差异模式,且内质网膜(ERM)蛋白质组分析中,SeeID 成功鉴定出 284 种高置信度内质网膜蛋白,其中 90% 为已知分泌途径蛋白,特异性媲美 miniSOG、TurboID 等主流邻近标记技术,且优于 APEX2(图3)。
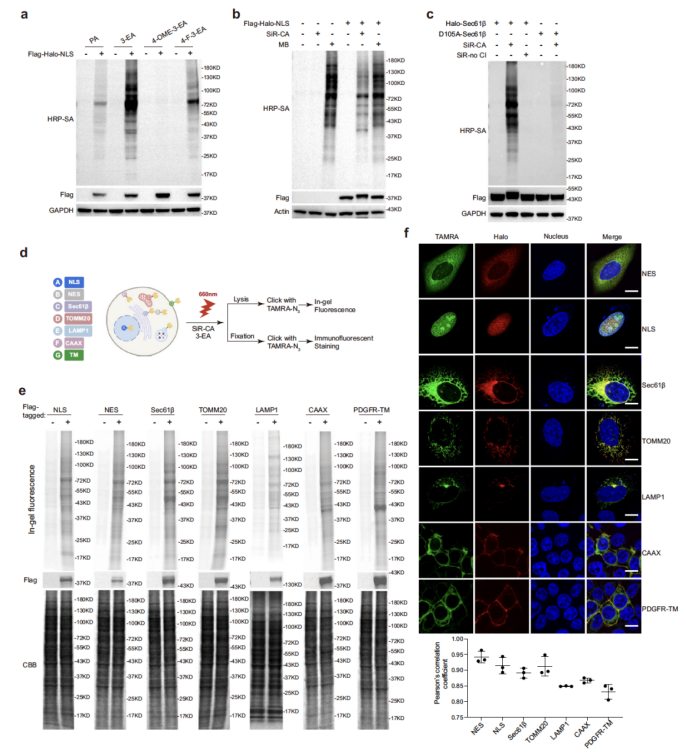
图2. SeeID用于活细胞标记
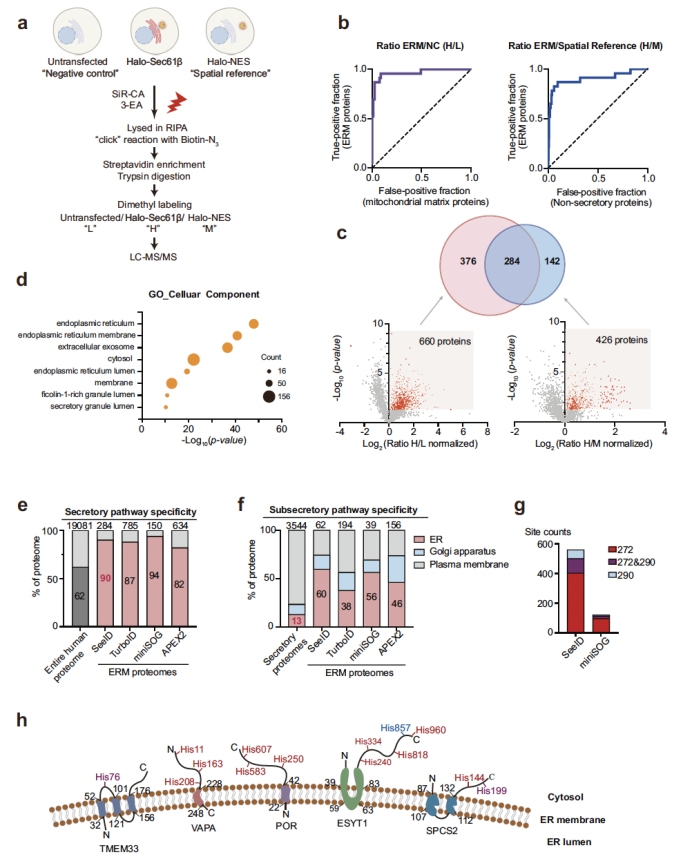
图3. SeeID与其他邻近标记技术的比较
为探索 SeeID 在未知蛋白质互作发现中的潜力,研究团队将其应用于癌症领域的关键 oncogene——KRAS 的互作组分析(图4)。KRAS 突变是人类癌症中最常见的基因突变之一,但其互作网络仍未完全解析。研究构建了稳定表达 Halo-KRASWT 的 HeLa 细胞与 Halo-KRASG12C 的 SW1573 细胞,通过 SeeID 共鉴定出 427 种 KRAS 互作蛋白,其中 212 种为未被 BioGRID 数据库收录的新互作蛋白。这些新蛋白包括与抗 EGFR 药物耐药相关的 AXL、胰腺癌中高表达的 OSBPL5,以及促进胶质瘤进展的 PHLDA1;通过邻近连接实验(PLA)与免疫共沉淀(Co-IP)进一步验证了这些互作的真实性,为 KRAS 突变癌症的治疗靶点开发提供了新线索。
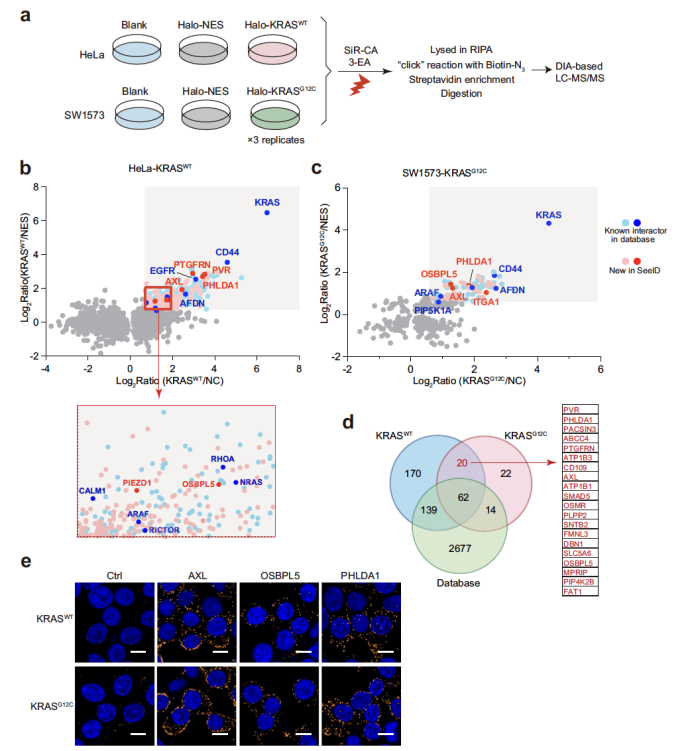
图4. SeeID用于分析KRAS互作蛋白组
SeeID 的另一重要突破在于实现了动态蛋白质互作组的追踪,研究团队以 PINK1/Parkin 介导的线粒体自噬(mitophagy)为模型展开探索(图5)。线粒体自噬是细胞清除受损线粒体的关键过程,Parkin 的 translocation 与动态互作是其核心调控环节。研究使用小分子 BL-918 诱导 Parkin translocation,通过活细胞成像实时追踪到:0 h 时 Parkin 弥散分布于胞质,2 h 时形成囊泡样聚集并开始向受损线粒体迁移,4 h 时完全定位于线粒体(PCC 从 0.44 升至 0.85)。同时,在这三个时间点通过 SeeID 捕获 Parkin 的互作组,发现 2 h 时 45 种蛋白酶体复合物相关蛋白中有 29 种的丰度显著上升(Ratio>1.5),而 4 h 时丰度下降。这一动态变化表明,泛素 - 蛋白酶体系统在 mitochondrial 自噬早期即参与受损线粒体蛋白的降解,此前尚未有研究通过邻近标记技术揭示这一动态过程,凸显了 SeeID 在动态生物学过程研究中的独特价值。
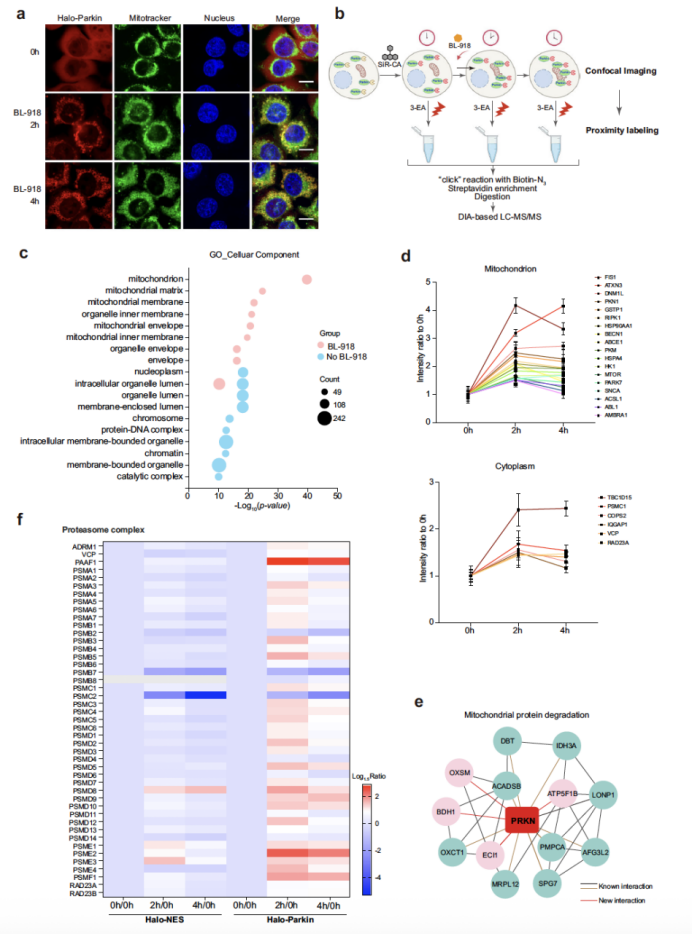
图5.基于荧光成像的Parkin动态蛋白互作组分析
近红外光的深组织穿透性是 SeeID 的重要优势,研究团队进一步验证了其在体内的应用潜力 —— 小鼠大脑的时空可控邻近标记。通过立体定位注射,将携带 Halo-TM(细胞膜靶向 Halo 标签蛋白)的 AAV 病毒导入小鼠海马体与视觉皮层,待病毒表达 2-3 周后,在急性脑切片中,1 μM SiR-CA 与 500 μM BA 处理结合 660 nm LED 照射,可在海马体区域观察到强烈的特异性标记信号;而在在体实验中,向小鼠视觉皮层注射 SiR-CA 与 BA 后,经 30 分钟 660 nm LED 照射,标记深度可达约 2 mm,且质谱分析鉴定出 60 种富集蛋白,其中 62% 与膜、囊泡或细胞外基质相关,包括神经递质受体(Gabra2、Gria1)、神经细胞黏附分子(Ncam1)等突触相关蛋白,证实了 SeeID 在体内深层组织中研究特定区域蛋白质互作的能力。
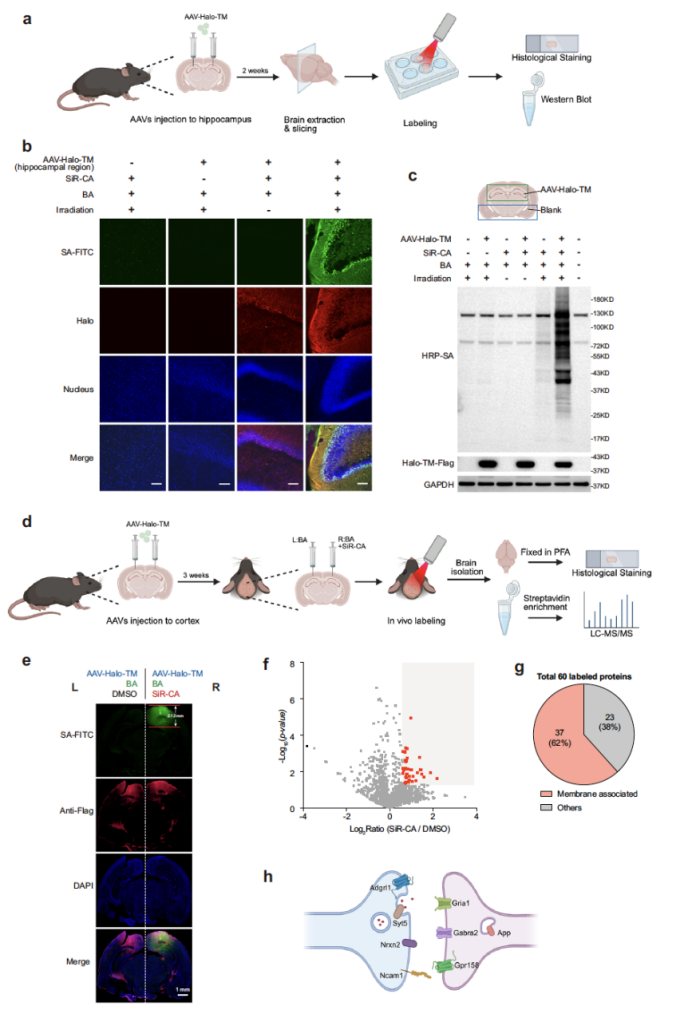
图 6. SeeID在活体蛋白邻近标记中的应用
相较于现有技术,SeeID 具有三大核心优势:一是 “成像 - 标记” 一体化,无需额外免疫染色即可实现目标蛋白动态追踪与互作组分析的同步;二是近红外光调控,660 nm 光对生物组织损伤小且穿透深,解决了蓝光 / 绿光调控技术的组织穿透局限;三是低细胞毒性与高特异性,SiR-CA 的荧光特性使其仅在结合目标标签后才激活标记,显著降低非特异性背景与细胞损伤。当然,技术仍存在改进空间,如 SiR 的单线态氧生成效率有待提升,以进一步缩短照射时间、提高时间分辨率。
综上,SeeID 技术通过巧妙整合硅罗丹明的荧光与光催化特性,成功连接了荧光成像与邻近标记技术,为活细胞与体内动态蛋白质互作组研究提供了全新工具。其在细胞器生物学、癌症机制、神经科学等领域的应用潜力,有望推动生命科学研究从 “静态描述” 向 “动态解析” 的跨越,为疾病机制研究与药物研发提供新的技术支撑。
致谢
清华大学药学院储凌副教授、秦为研究员为本文的共同通讯作者,博士后王文静、博士研究生郭弘扬、博士后闫潇洒为本文的共同第一作者,中国科学院遗传与生物发育研究所武照伐研究员、清华大学生命学院赵昕宇老师为本文提供了重要的实验支持。
科学家小档案

储凌 清华大学药学院
储凌博士2012年本科毕业于中国科学技术大学化学系,2017年于斯克里普斯研究所获得化学博士学位。2017至2021年在耶鲁大学从事博士后研究,2021年3月起加入清华大学药学院,任助理教授、副教授。储凌博士期间从事有机化学研究,发展了首例基于动力学拆分的钯催化碳氢键活化反应,随后在博士后阶段分别从事化学生物学与药物化学研究,期间他发展了基于小分子探针的多色、长时间、超高分辨活细胞荧光成像技术,解决了在超分辨细胞器成像中光漂白的问题。他还设计并合成了首个能够降解致癌蛋白KRAS的蛋白降解靶向嵌合体 (PROTAC),为治疗KRAS突变的癌症提供了新的思路。储凌博士目前的研究方向有:1) 光稳定的蛋白荧光成像方法;2)基于小肽的蛋白标记新方法; 3) 近红外光启动、时空可控的生物技术的开发; 4) 基于新靶点、新机制的药物化学研究。课题组主页:chu-lab.org。储凌课题组长期招聘有机化学、化学生物学及有生物学背景的博士后,有意向者请邮件关系:lingchu@mail.tsinghua.edu.cn.

秦为 清华大学药学院
秦为,清华大学药学院助理教授,于 2014 年在北京理工大学获理学学士学位,于 2019 年在北京大学获理学博士学位,导师为北京大学化学与分子工程学院陈兴教授和王初教授。此后在美国斯坦福大学从事博士后研究,导师为美国科学院院士Alice Y. Ting教授。于2023 年 3 月加入清华大学药学院开始独立研究工作,任课题组长、博士生导师。先后入选国家自然科学基金优秀青年科学基金(海外)项目、 2023年麻省理工科技评论中国区35岁以下35人、2023年清华拜耳研究员奖,同时担任中国生物工程学会系统生物医学专业委员会委员。主持国家重点研发计划青年科学家项目,国家自然科学基金重大研究计划培育项目,面上项目等多个科研项目。秦为研究员长期致力于发展新型化学生物学和蛋白质组学技术,系统描绘生物大分子在时间、空间、功能和相互作用等多维度的动态调控网络。近年来以第一作者或通讯作者在Cell、Nat Methods、Nat Chem Biol、Nat Commun、JACS、Angew Chem Int Ed、PNAS 等杂志发表论文十余篇。