过敏性哮喘(Allergic asthma)是一种慢性炎症性疾病,通常由吸入性过敏原引发,多见于儿童时期。尘螨(House dust mites, HDM)是过敏性哮喘的主要致病原,全球1%-2%的人口受其影响。该疾病的发病机制涉及先天免疫系统与Th2细胞的协同作用,驱动IgE依赖性过敏反应,并伴随嗜酸性粒细胞性气道炎症和气道高反应性。肺泡巨噬细胞(AMs)和树突状细胞(dendritic cells,DCs)是参与过敏性哮喘的两类先天免疫细胞,其功能在哮喘进展过程中受到精细调控,但具体的分子调控机制尚不明确。Tripartite motif-containing protein 33 (TRIM33)是一种能调节免疫细胞分化和功能的多功能蛋白,对固有免疫细胞的分化和功能具有重要调节作用。但是它在过敏性哮喘状态下是否对AMs和DCs具有调控作用尚不清楚。
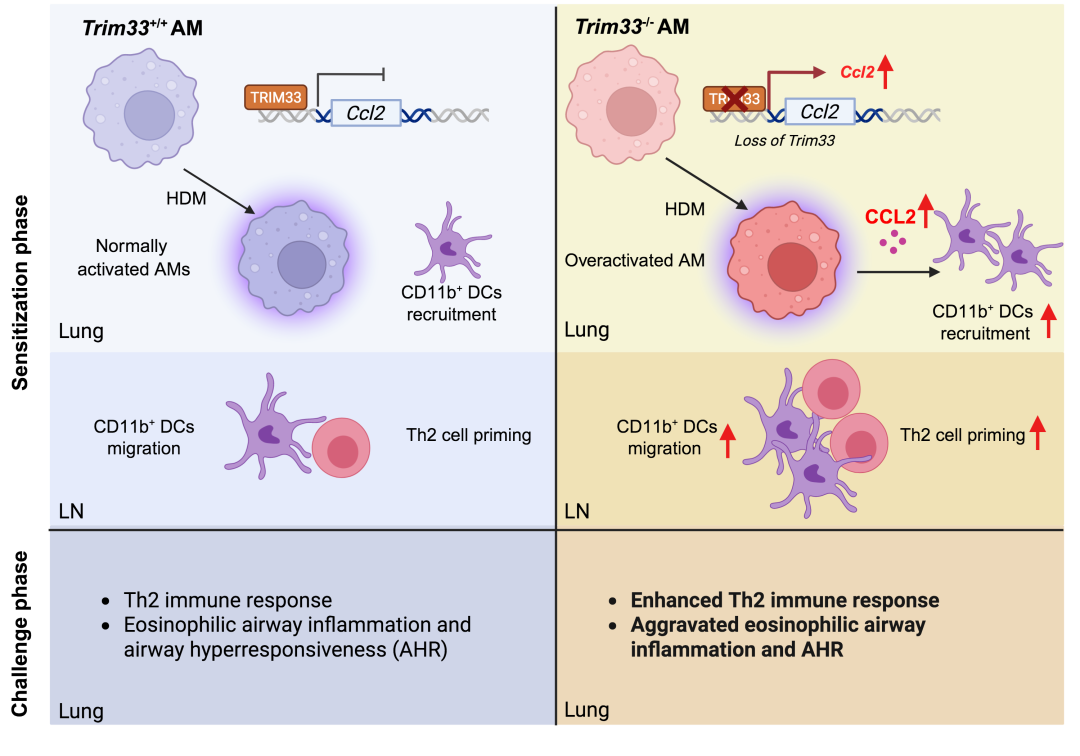
TRIM33调控肺泡巨噬细胞及哮喘进展的模式图
近期清华大学免疫学研究所吴励教授团队在 Mucosal Immunology上在线发表了题为“TRIM33 prevents the exacerbation of allergic asthma by restricting the overactivation of alveolar macrophages”的研究论文。该研究发现TRIM33能抑制AMs的过度活化,在过敏性哮喘进展中具有显著的保护作用。
本研究发现,在CD11c+ 细胞中特异性敲除TRIM33(ItgaxCre-GFPTrim33fl/fl 小鼠)会导致肺稳态下AM和DC数量显著减少,并在HDM诱导的过敏性哮喘模型中加剧气道炎症和Th2免疫反应。有趣的是,TRIM33缺失并不影响CD11b+ DC介导2型免疫应答的能力,但通过回输正常AMs可逆转哮喘加重的表型,表明AMs是TRIM33调控哮喘的关键靶细胞。更深入的机制研究表明,TRIM33缺失会增强AMs的活化并上调Ccl2表达,从而增加CD11b+ DCs的募集,进一步加剧Th2免疫应答。
进一步实验发现CCL2阻断抗体可干预这个过程,从而显著抑制TRIM33缺陷小鼠在过敏原刺激后CD11b+ DCs向肺部和纵隔淋巴结的异常募集和迁移,进而明显缓解过敏性哮喘的症状。这一结果表明,CCL2是TRIM33缺陷导致哮喘加重的关键效应分子,其信号通路可能成为干预过敏性哮喘的潜在治疗靶点。
清华大学免疫学研究所已出站博士后吕娇燕,博士毕业生苏子砚以及清华大学基础医学院-附属第一医院双聘项目吴韬博士为本文的共同第一作者。清华大学基础医学院、免疫学研究所吴励教授为本文的通讯作者。吴励教授团队已毕业博士田玉洁、刘鑫、刘家琛、李晓光、赖文龙,以及西湖大学董晨教授也为本研究做出重要贡献。本研究受到清华-北大生命联合中心、国家自然科学基金及科技部国家重点研发计划等项目资助。
原文链接
https://doi.org/10.1016/j.mucimm.2025.07.003