近年来,以免疫检查点阻断(ICB)为代表的免疫治疗为癌症患者带来新的希望,但T细胞耗竭导致的低响应率仍是癌症治疗主要挑战。研究发现,TIM3作为新一代免疫检查点,在肿瘤微环境(TME)中特异性高表达于耗竭CD8⁺ T细胞,抑制抗肿瘤免疫。虽然TIM3阻断可部分恢复T细胞功能,但单药效果有限。细胞因子IL-2作为T细胞激活的第三信号,能够有效促进T细胞和NK细胞的激活与扩增。在T细胞耗竭的过程中,IL-2信号通路是最早丧失的功能之一,直接影响T细胞的免疫效应能力。特别是在TIM3+耗竭T细胞中,IL-2在维持其功能和调控其转录程序中发挥着关键作用。然而,IL-2的全身性应用常引发严重的剂量限制性毒性(如血管渗漏综合征和低血压),极大限制了其临床应用。此外,肿瘤微环境的酸性条件会显著降低IL-2的稳定性与生物活性,进一步削弱其抗肿瘤疗效。
6月3日,清华大学基础医学院傅阳心教授团队在Nature Communications在线发表了题为 “TIM3-blockade synergizes with IL2 in alleviating intra-tumoral CD8+T cell exhaustion” 的研究成果,该研究通过构建anti-TIM3抗体和IL-2前体的融合蛋白,Anti-TIM3抗体在结合阻断TME中免疫检查点TIM3的同时,能够将IL-2靶向转运至肿瘤微环境,在有效增强抗肿瘤免疫反应的同时避免IL-2引起的副作用。

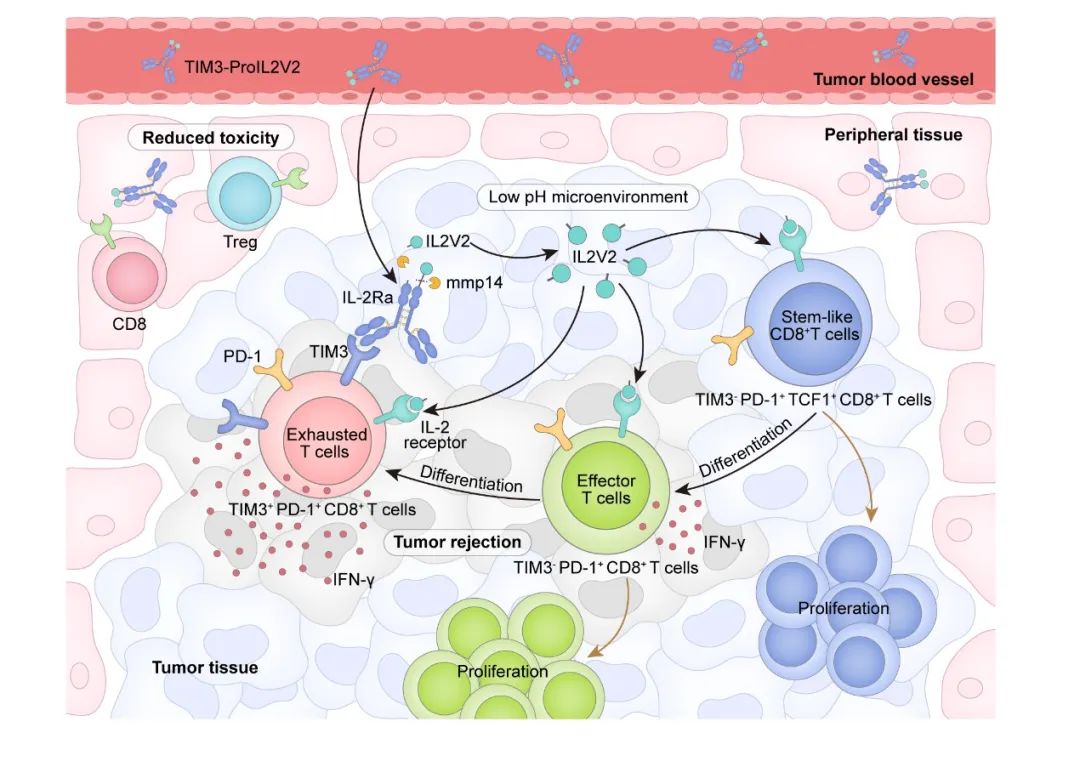
为了克服TME中酸性条件对IL-2活性的抑制,研究团队首先筛选出一个对低pH环境具有更强适应性的IL-2突变体(IL2V2),具有更高的IL-2β受体亲和力,显著增强了其在TME中免疫活化能力。随后,研究者将IL2V2与IL-2α受体通过可被MMP酶切割的连接肽连接,构建出前体分子ProIL2V2。该设计使得IL2V2在外周循环中被α链受体遮蔽,避免与受体结合而引发毒副作用;而在肿瘤组织中,由于MMP酶的高表达,可特异性切断连接肽,释放出具生物活性的IL2V2,从而增强其局部抗肿瘤效应。在此基础上,研究团队将ProIL2V2与抗TIM3抗体融合,构建出一个抗体-细胞因子复合物(TIM3-ProIL2V2)。该融合蛋白首先增大了分子量,从而延长半衰期,可以降低细胞因子的治疗剂量;然后通过抗TIM3抗体的靶向能力,将IL2V2精准递送至肿瘤部位,有效限制其在正常组织中的扩散,显著降低毒副作用。
TIM3-ProIL2V2展现出优于组合使用anti-TIM3和ProIL2V2的显著抗肿瘤效果。从机制上看,TIM3-ProIL2V2不仅能够重塑肿瘤微环境中TIM3⁺ CD8⁺ T细胞的功能,显著增强其IFN-γ和Granzyme B等关键效应分子的分泌能力,还通过“旁观者效应”激活TIM3⁻ TILs群体,包括PD-1⁺TIM3⁻干细胞样和早期效应T细胞,促进其扩增并向TIM3⁺效应T细胞分化。该过程有助于在TME中维持T细胞群体的功能活性和数量稳定,进一步提升整体的抗肿瘤免疫反应。
攻克"冷肿瘤"是当前ICB和CAR-T细胞治疗面临的关键挑战。研究团队在PD-1/L1抑制剂和过继性T细胞疗法耐药的B16F10冷肿瘤模型中,创新性地采用TIM3-ProIL2V2联合抗PD-L1抗体或OT-I+ CD8+ T细胞过继治疗,显著提升了肿瘤浸润T细胞数量以及恢复了耗竭T细胞杀伤功能,最终在部分模型中观察到肿瘤完全消退。更值得注意的是,人源化TIM3-ProIL2V2在多种人源肿瘤模型中均展现出卓越的抗肿瘤活性,凸显了其进一步临床转化应用的潜力。
本研究的核心创新在于TIM3-ProIL2V2融合蛋白的双重作用机制:anti-TIM3抗体能够特异性靶向肿瘤微环境中的耗竭CD8+T细胞,实现IL-2的精准递送;另一方面,通过“旁观者效应”激活TIM3⁻ TILs群体,包括PD-1⁺TIM3⁻干细胞样和早期效应T细胞。这种设计不仅有效克服了传统IL-2治疗的全身毒性问题,更通过时空特异性激活策略,为"冷肿瘤"的免疫治疗提供了突破性解决方案。该研究成果不仅拓展了抗体-细胞因子偶联药物的开发思路,更为克服免疫检查点抑制剂和过继性细胞疗法的耐药性开辟了新途径,具有重要的临床转化价值。
该研究的通讯作者是清华大学基础医学院傅阳心教授和张旭浩博士。清华大学基础医学院张旭浩博士、高宇博士、以及昌平实验室廖慧萍博士作者是本文的共同第一作者。清华大学基础医学院王文彦博士、杨再立博士、曹伟安、文婧以及军事医学研究院李葛博士为课题提供了重要帮助。本研究得到军事医学研究院韩根成团队大力支持。
论文链接:
https://doi.org/10.1038/s41467-025-60463-4