膀胱癌(Bladder Cancer,BC)是全球第十大常见癌症,年新发病例基数庞大。尽管近年来免疫检查点抑制剂为膀胱癌晚期患者的治疗带来了希望,但仍然有近半患者治疗后出现复发或转移,晚期患者五年生存率不足10%,其核心治疗瓶颈在于肿瘤微环境(tumor microenvironment,TME)的免疫抑制机制尚未明确。近年来关于肿瘤微环境的异质性的研究取得了一定的进展,但对膀胱癌中髓系细胞亚群的免疫学认识仍然有限,极大限制了靶向髓系细胞的新型免疫治疗策略的开发,因此,对膀胱癌中的髓系细胞进行更全面更深刻的探索,有望揭示关键的免疫调节特征和新型治疗靶点。
该研究由清华大学吴励教授团队、国家蛋白质科学中心(北京)朱云平研究员团队和中国医学科学院肿瘤医院邢念增副院长团队合作完成,于2025年6月25日在《柳叶刀》旗下子刊 eBioMedicine 杂志发表了题为"High-resolution transcriptome atlas of bladder cancer highlights the functional myeloid subsets in modulating immune microenvironment"的研究论文。清华大学基础医学院刘家琛博士、史真博士(现就职于北京大学第三医院)、中国医学科学院肿瘤医院李亚健主治医师,国家蛋白质科学中心马洁副研究员和北京安诺优达姚佳英博士为共同第一作者。吴励教授、张建宏助理研究员、朱云平研究员和邢念增主任医师为共同通讯作者。该研究获得国家自然科学基金、科技部国家重点研发计划和清华北大生命科学联合中心的支持。
该研究对11例膀胱癌患者的配对癌和癌旁组织进行了单细胞转录组测序分析(图1a),通过对免疫细胞亚群的精细聚类与功能注释,为膀胱癌免疫调控提供全新见解,并通过小鼠膀胱癌模型对发现的靶点进行了验证。
该研究的重要发现包括:
1. TREM2high巨噬细胞与CMA1high肥大细胞在膀胱癌组织中发生显著代谢重编程,小鼠模型中敲除Trem2基因可重塑免疫微环境;
2. CMA1high肥大细胞富集提示膀胱癌不良预后,而CD1C+树突状细胞的存在可作为保护性的预后标志物;
3. 通过构建四种免疫细胞模块集群(Immune Cellular Modules),为膀胱癌精准免疫分型提供新的工具(图1b);
4. 细胞互作网络分析发现APP(Amyloid Precursor Protein,与阿尔茨海默症相关蛋白同源)信号轴的关键作用;并建立了一种原位小鼠膀胱癌模型,验证了敲低APP基因显著抑制肿瘤进展(图1c)。
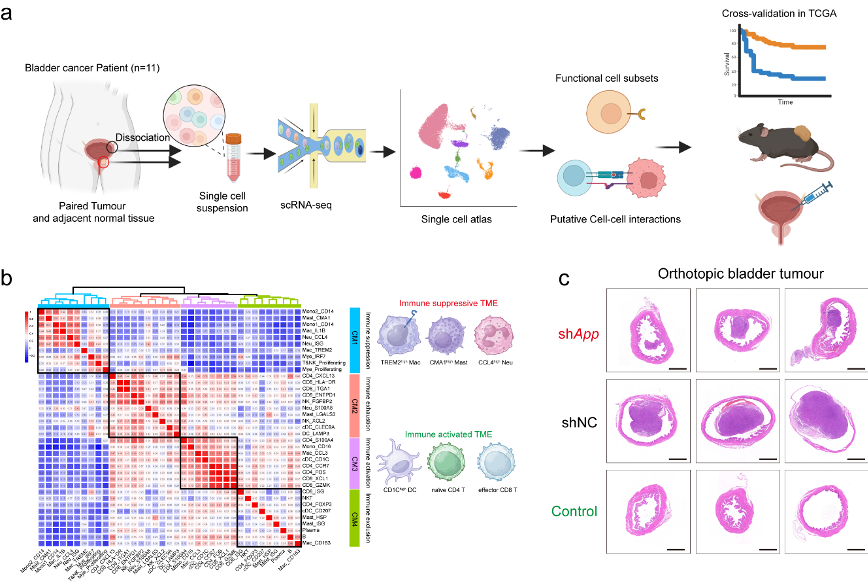
图1、膀胱癌单细胞全景的建立、免疫细胞模块集群的建立和小鼠原位膀胱癌模型研究
研究团队受邀为本文设计了封面图(如下),展现了膀胱癌免疫微环境的研究及发现:

1. 整体轮廓——展现膀胱器官的形态,象征研究聚焦于膀胱组织微环境;
2. 探索过程——潜水艇代表对免疫微环境的系统性探索;
3. 图中两侧地貌差异呈现了膀胱癌导致的组织结构畸变:左侧翠绿生态区(平整珊瑚/繁茂水草/气泡)象征癌旁正常组织及抑癌因子(如CD1C+ DC、T细胞);右侧暗红病变区(崎岖礁石/散落的小花/凶恶的小鱼)代表癌组织及促癌因子(如TREM2、APP)。
文章全文在线链接:
https://doi.org/10.1016/j.ebiom.2025.105801