近日,清华大学医学院张林琦教授和生命科学学院王新泉教授研究团队联合深圳市第三人民医院(南方科技大学第二附属医院)/深圳国家感染性疾病临床医学研究中心张政教授/鞠斌特聘研究员团队和新加坡国立大学Justin Jang Hann Chu教授团队,在《自然免疫》(Nature Immunology)期刊在线发表题为“新冠病毒原始株感染能够诱导针对奥密克戎突变株的广谱中和抗体”(Infection with wild-type SARS-CoV-2 elicits broadly neutralizing and protective antibodies against omicron subvariants)的研究论文,这是该合作团队在抗新冠抗体研究一系列成果后又一重要工作,为抗体药物和疫苗优化提供了重要科学依据和指导(《自然》(Nature, https://www.nature.com/articles/s41586-020-2380-z)、《自然通讯》(Nature Communications, https://www.nature.com/articles/s41467-020-20501-9; https://www.nature.com/articles/s41467-021-24514-w)、《细胞研究》(Cell Research, https://www.nature.com/articles/s41422-021-00487-9)。

层出不穷的新冠病毒突变株,严重冲击着原始株病毒感染者和疫苗接种者体内建立的免疫屏障。奥密克戎(Omicron)及其子代病毒是突变株的典型代表,其表面刺突蛋白(S)高度突变,使其具有逃逸抗体识别的超强能力,是当前全球流行的主要突变株。但是,这些突变株对抗体中和能力的影响程度如何?人体内是否存在对突变株保持广谱高效中和能力的抗体?这些抗体识别病毒的靶点、抗病毒机制和保护能力如何?对于这些问题的回答,是我们客观认识人体抗体反应能力的关键,也是我们优化疫苗和免疫策略的重要指导和参考。
该研究以这几个关键问题为切入点,从9名新冠原始株病毒感染康复者中分离到476株S蛋白特异性单克隆抗体,其中45%是结合S2表位抗体,而结合RBD和其他表位抗体各占不足30%(图1a);然而,假病毒中和实验发现,大多数中和抗体主要来自于RBD抗体(30%, 40/132),NTD抗体次之(17/130),而S2抗体最少(1/214)(图1b),说明RBD是诱导中和抗体的关键抗原组分。研究人员重点评估了40株RBD抗体的广谱中和能力,13株RBD抗体能够保持对Beta和Delta等重要突变株的中和能力,但随着Omicron突变株的出现,其中6株抗体失去了中和能力。但惊奇的是,仍然有7株抗体能够中和所有的突变株,说明新冠病毒原始株感染形成的免疫印迹确实具备对抗新冠病毒突变逃逸的潜力。基因分析发现高活性的广谱中和抗体偏好使用IGHV3-53家系,再次突出了这类“公共抗体”的重要性(图1c)。动物保护实验显示4株代表性的广谱中和抗体(P2-1B1, P5S-2B10, P5-1H1, P2S-2E9)能够有效抑制Omicron BA.1和Beta突变株活毒的感染(图1d-g)。结构分析显示广谱中和抗体识别病毒的不同表位,能够一定程度耐受其作用位点发生突变,P5S-2B10, P5-1H1, P2-1B1属于经典的Class 1抗体,模仿和直接竞争ACE2受体识别病毒RBD蛋白,P2S-2E9属于Class 3抗体,P5S-3B11属于Class 4抗体(图1h-j)。该研究明确回答了3个重要科学问题:1)新冠原始株病毒感染能够诱导超级广谱的中和抗体;2)RBD蛋白依旧是诱导广谱高效中和抗体的理想靶标;3)模仿受体结合和IGHV3-53家系偏好的中和抗体发挥重要作用。
进一步的研究结果显示(数据未发表),其中一些抗体对当前我国流行的BF.7, BA.5.2和国际上流行的BQ.1, BQ.1.1, XBB, XBB.1和XBB.1.5等突变株均保持高效中和能力。该研究为我们全面认识人体抗体反应的能力,为下一代新冠疫苗的设计和优化提供了重要参考。分离获得的广谱高效中和抗体是新一代抗体药物的最佳候选,也为如何从原始株形成的免疫印迹中特异性诱导这些高效广谱中和抗体提出了新的研究目标和方向。
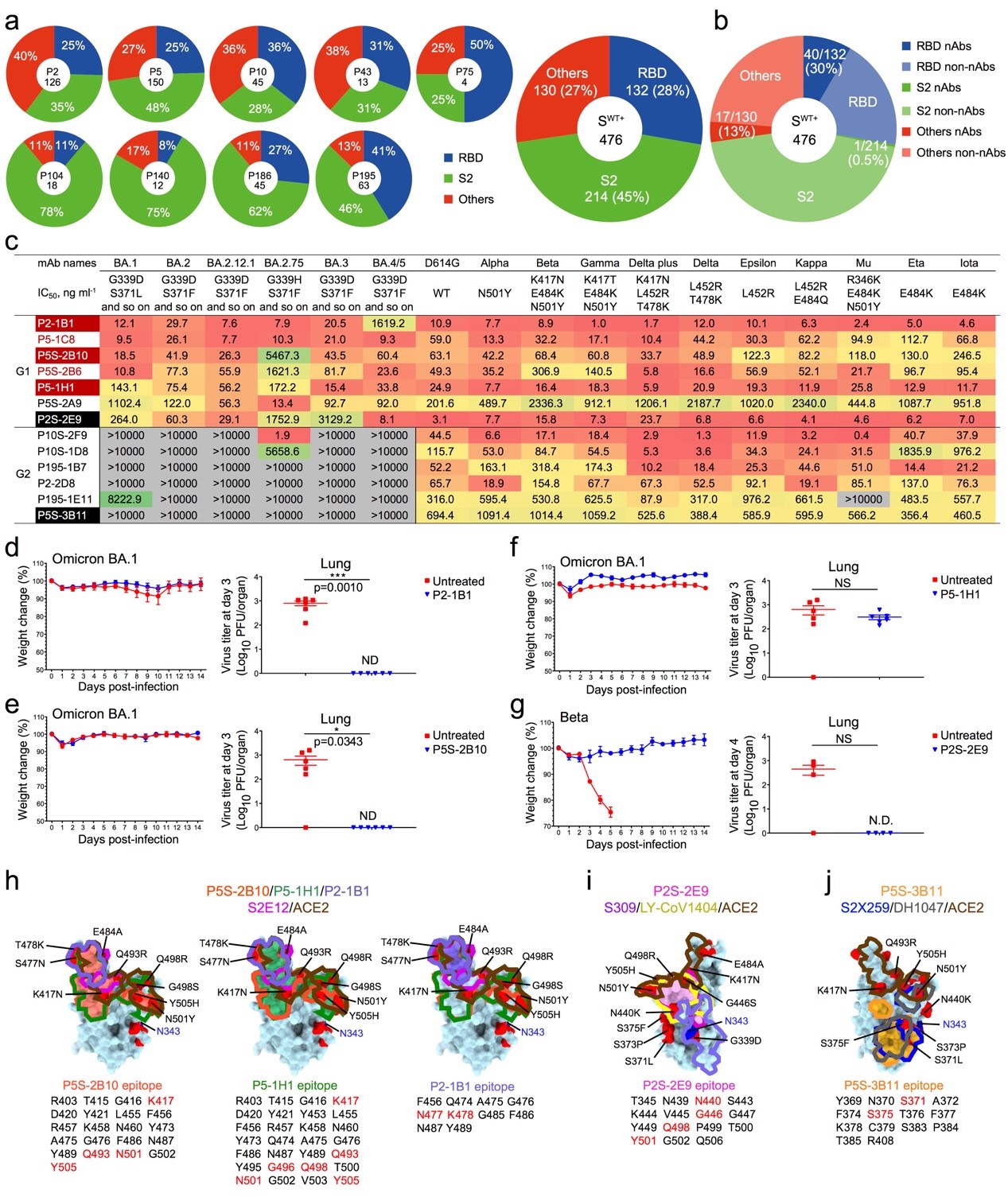
图. 新冠原始株病毒感染诱导广谱中和抗体研究
清华大学张林琦教授、深圳市第三人民医院(南方科技大学第二附属医院)/深圳国家感染性疾病临床医学研究中心张政教授、清华大学王新泉教授、新加坡国立大学Justin Jang Hann Chu教授为本文共同通讯作者。深圳市第三人民医院特聘研究员鞠斌、清华大学副研究员张绮、博士生王子谊、新加坡国立大学助理研究员Zhen Qin Aw、清华大学博士生陈鹏为本文共同第一作者。该研究得到了国家科技重大专项、国家自然科学基金、北京市科委、广东省自然科学基金、深圳市科技创新委员会、清华万科科学研究项目、春风基金、腾讯基金会、水滴筹基金、泰禾基金等支持。
原文链接:https://www.nature.com/articles/s41590-023-01449-6