2023年03月27日,清华大学医学院彭敏团队在《Journal of Experimental Medicine》杂志发表题为“VMP1 prevents Ca2+ overload in endoplasmic reticulum and maintains naive T cell survival”的研究论文(https://doi.org/10.1084/jem.20221068),揭示了VMP1在稳态下内质网钙离子释放和T细胞存活中的关键作用。
钙离子信号对哺乳动物细胞至关重要。细胞内的钙离子主要储存于内质网,而内质网是蛋白质和脂质合成加工以及信号转导的关键细胞器。因此,维持内质网钙稳态是生命活动的基础之一。内质网钙离子水平由两个相反的过程所决定(图1A):1)SERCA介导的ATP依赖的内质网钙泵入,2)内质网自发或信号诱导的钙释放。在外界信号刺激下,如淋巴细胞被抗原激活后,内质网通过IP3R等通道释放钙离子,内质网钙离子水平降低被STIM1等感知,从而开放细胞膜表面CRAC通道引起外钙内流,即经典的SOCE通路(图1A)。
与机制清晰的SOCE形成鲜明对比的是,稳态下内质网钙离子释放的重要性和分子机制一直被忽略。早在1964年,Martonosi等就报导哺乳动物细胞内质网在静息状态下会自发地持续地释放钙离子,但分子机制一直不清楚(图1A)。该课题的目标是发现并鉴定参与稳态下内质网钙离子释放的关键因子。
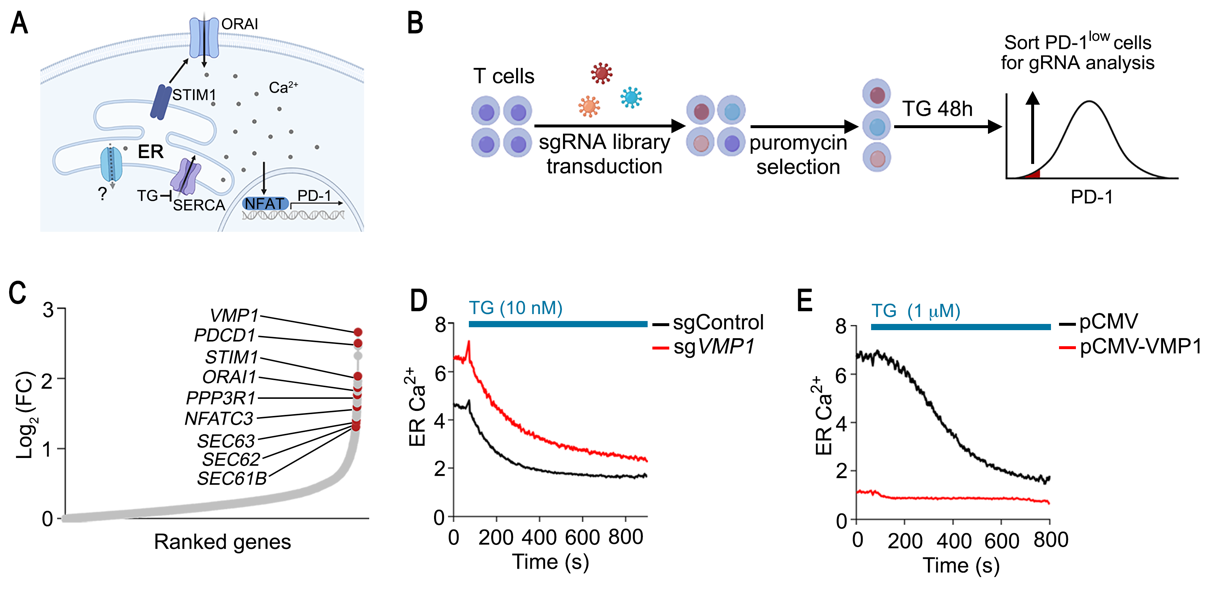
图1.基于SOCE-NFAT-PD-1的全基因组筛选发现VMP1在内质网钙释放中的关键作用。
A,内质网钙稳态和基于PD-1表达水平的筛选原理示意图;B,筛选流程;C,筛选结果;D,VMP1缺失导致内质网钙离子过载;E,VMP1过表达完全释放内质网钙离子
在该项目之前,领域内多个课题组尝试过基于SOCE诱导的NFAT细胞核定位的遗传学筛选,试图寻找SOCE新的调控因子,但效果不佳。由于NFAT的核定位需要逐个细胞进行影像学分析,无法实现高通量全基因组筛选。课题组创新性地利用NFAT靶基因PD-1作为筛选的指标(图1A),意外发现了VMP1在稳态下内质网钙释放中不可或缺的作用(图1B,C)。
VMP1是内质网上的多次跨膜蛋白,参与调控自噬和脂代谢。尤为重要的是,VMP1是黄病毒(如寨卡病毒)和冠状病毒(如新冠病毒)感染的关键宿主因子。课题组发现,VMP1是稳态下内质网钙离子释放的充分必要因子(图1D,E)。VMP1缺失导致T细胞内质网钙离子过载和内质网应激,并引起继发性线粒体钙离子过载,导致T细胞凋亡和免疫应答缺陷 (图2)。
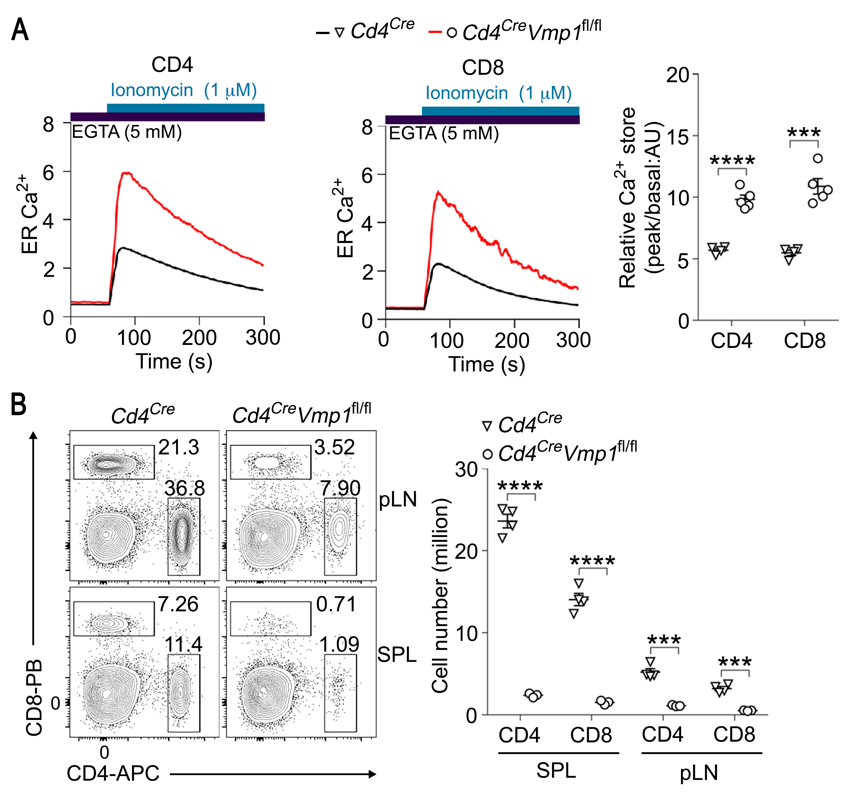
图2.VMP1缺失导致T细胞内质网钙离子过载和细胞死亡
A,VMP1缺失导致T细胞内质网钙离子过载;B,VMP1缺失导致外周T细胞显著减少
此外,课题组发现272位天冬氨酸(D272)对VMP1钙离子释放调控活性至关重要,当272位的天冬氨酸突变为天冬酰胺(D272N),VMP1完全失去钙离子释放活性(图3)。D272N点突变小鼠进一步证明VMP1在T细胞中的所有功能都依赖于其对内质网钙释放的调控。
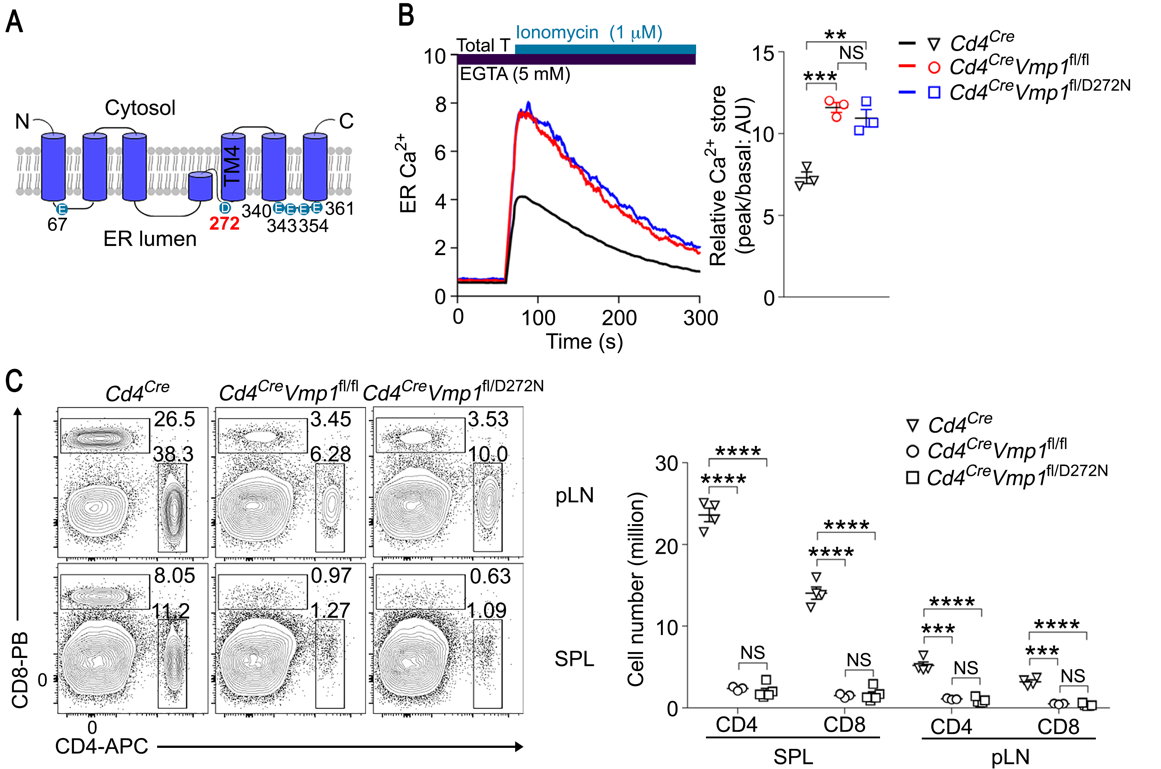
图3. D272是VMP1钙离子释放功能的关键氨基酸
A,VMP1示意图以及D272位置;B,VMP1-D272N失去释放内质网钙离子能力;C,VMP1-D272N突变T细胞与VMP1缺失T细胞表型一致
该研究首次揭示了VMP1在内质网钙离子释放中的关键作用,是自1964年内质网自发性钙离子释放现象报导以来的重要进展。略显遗憾的是,由于技术方面的原因,该项目未能直接证明VMP1是否形成了钙通道。尽管如此,全细胞膜片钳实验结果表明VMP1可以诱导跨膜钙离子转运,提示VMP1极有可能是新型钙通道,课题组的后续研究将揭开这一谜题。
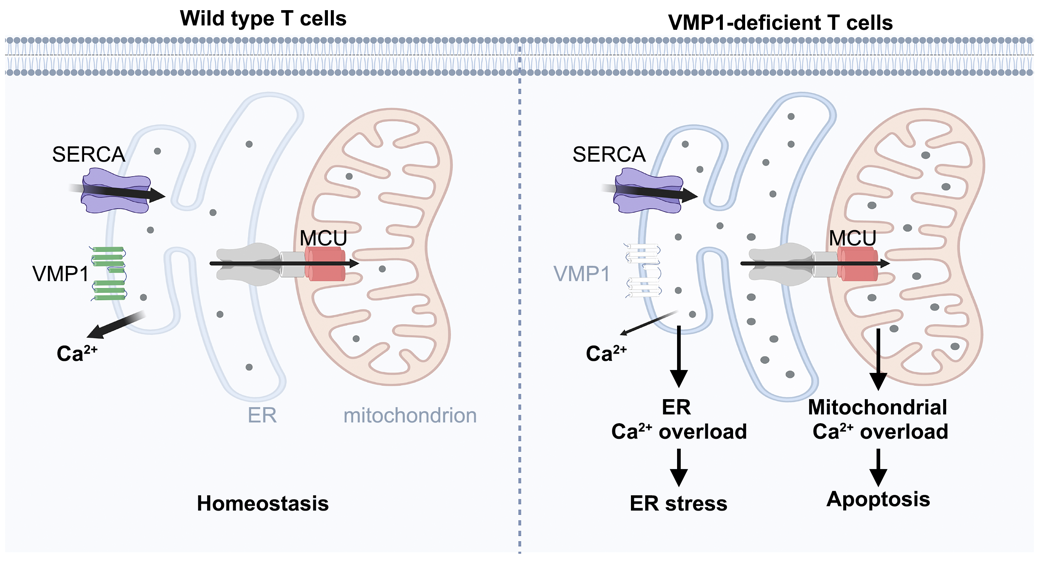
图4. 模型图
清华大学医学院彭敏副教授为该论文通讯作者,清华大学医学院已毕业博士生刘莹,2018级博士生马玉莹和许靖,2017级CLS博士生张光跃,以及博士后赵小翠为该论文共同第一作者,2019级博士生何子豪也为该论文做出了重要贡献。该项目的电生理实验得到了石彦教授实验室夏铁副研究员的大力帮助。该研究获得了国家自然科学基金委员会、清华-北大生命中心、清华大学免疫学研究所等资助。