近日,清华大学生物医学工程学院刘鹏研究员与基础医学院张林琦教授团队合作,在国际期刊《Advanced Science》在线发表题为《A versatile high-throughput single-cell screening platform for profiling antigen-specific long-lived B cells in blood and bone marrow》的研究论文。该研究提出并验证了一种模块化超疏水微孔阵列芯片(MoSMAR-chip)平台,可实现抗原特异性B细胞的单细胞高通量筛选与多组学分析,显著提升了对长寿命浆细胞(LLPCs)和记忆B细胞(MBCs)的解析能力,为疫苗评估、自身免疫研究及中和抗体筛选提供了强有力工具。
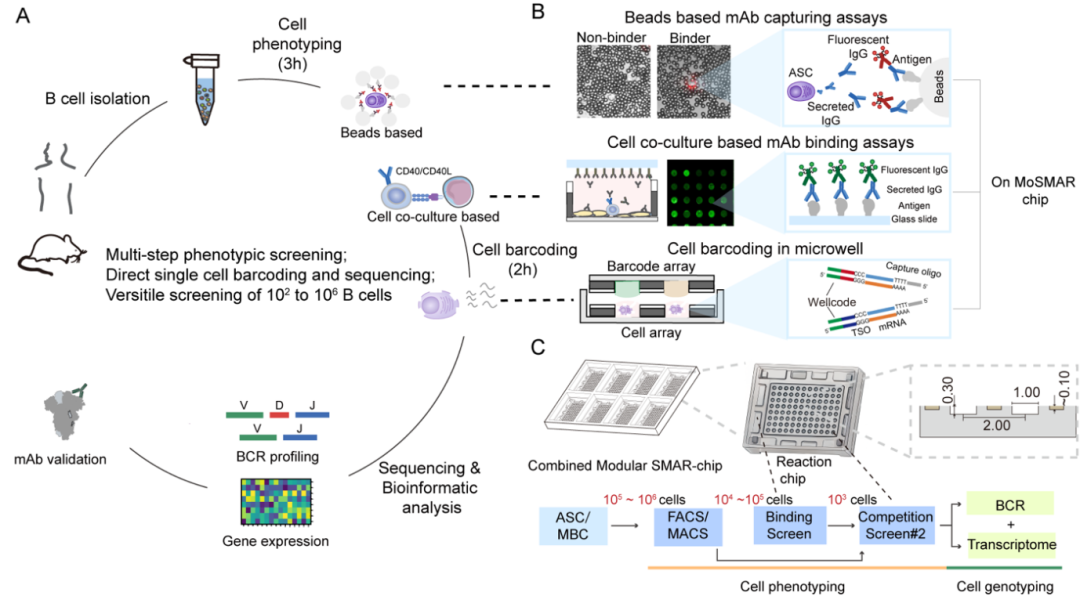
图1基于模块化超疏水微孔阵列芯片的抗体分泌细胞与记忆B细胞单克隆抗体(mAb)分离与表征整体流程设计
长期免疫记忆依赖于骨髓中持续分泌抗体的长寿浆细胞(LLPCs)以及外周血中可被再次激活的记忆B细胞(MBCs)。然而,LLPCs由于缺乏膜表B细胞受体(BCR),难以通过传统抗原探针法进行识别与回收。为突破这一技术瓶颈,研究团队构建了基于MoSMAR芯片与单细胞分布系统(SCDI)的高通量功能筛选平台,实现了从细胞功能识别到转录组与BCR组库分析的一体化流程,大幅简化实验步骤并提升了筛选通量。MoSMAR芯片采用超疏水材料构建液体隔离微反应环境,可一次性处理10⟡至10⁶个B细胞。通过在芯片中加入抗原包被微珠,并结合荧光二抗,在分泌抗体的浆细胞周围形成可视“荧光光环”,精确定位抗原特异性细胞。目标细胞随后被转移至微孔中进行多轮抗体功能筛选与结合能力表征,最终实现高效、可追溯的抗体分泌细胞识别与克隆分析。

图2 基于微珠的抗原特异性抗体分泌细胞(ASCs)筛选与表征方法在MoSMAR芯片上的应用
MBC在长期免疫应答中扮演着至关重要的角色,在再次感染时能迅速激活分化为ASCs。但MBC的一个挑战在于它们尚未主动分泌抗体,靠膜表面BCR识别抗原的筛选方法假阳性高、功能验证难,大多数高通量平台(如10X Genomics)无法整合功能与基因型信息。为实现对抗原特异性MBC的高效筛选与功能分析,研究团队基于MoSMAR微孔芯片平台构建了一套集激活、筛选、验证与测序于一体的单细胞工作流程。首先,将流式分选获得的抗原特异性的 MBCs分配至MoSMAR芯片的微孔中,并与表达CD40L的3T3 feeder细胞共培养,借助CD40-CD40L信号通路激活MBC向抗体分泌细胞转化。随后,通过芯片顶部贴合的抗原包被玻片,以原位ELISA方式检测每个微孔中分泌抗体的特异性和强度。对筛选出的抗原特异性细胞,研究人员进一步在微孔内引入SARS-CoV-2假病毒,并与ACE2靶细胞芯片对接,实现中和功能的单细胞水平验证。
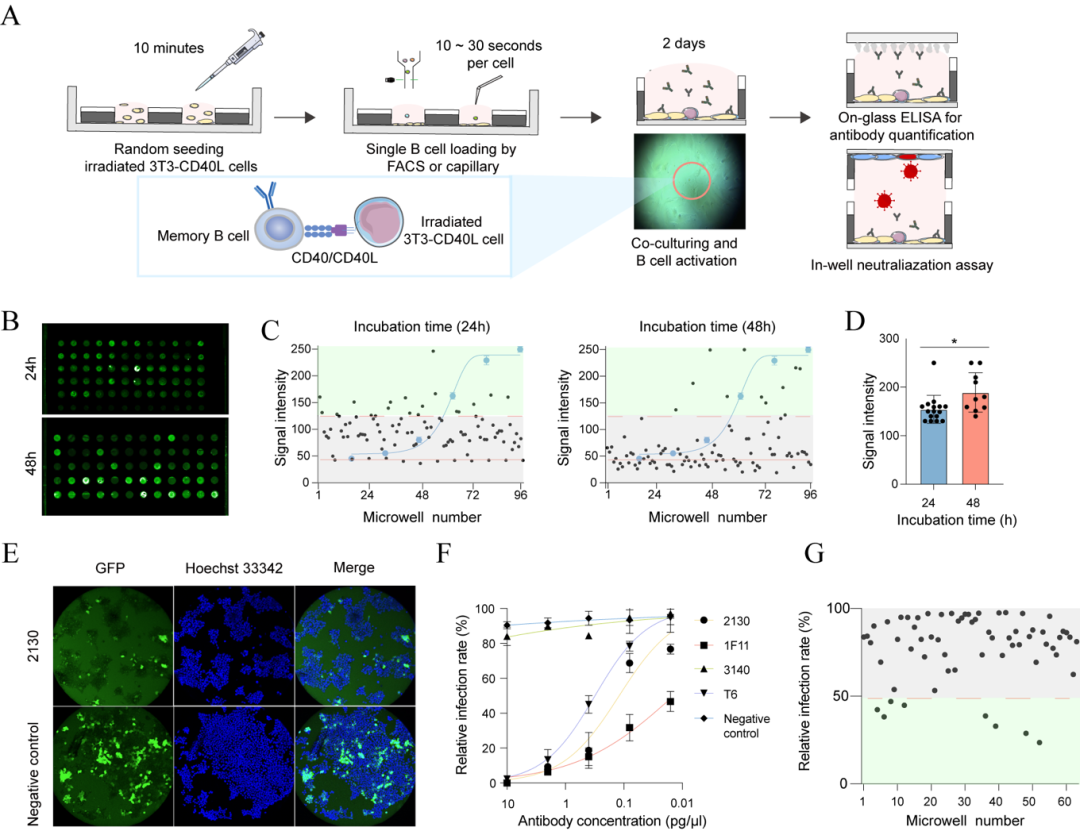
图3 基于共培养的抗原特异性记忆B细胞的筛选方法
为了在功能筛选基础上进一步解析单个B细胞的分子特征,研究团队开发了MoSMAR-seq,一种基于MoSMAR芯片的可位址编码(addressable)的单细胞转录组与免疫组库联合分析技术。该方法通过预先设计的模板转换寡核苷酸(TSO)引入“wellcode”,标记芯片中每一个微孔的位置,同时通过“chipcode”对整个芯片编号,实现样本溯源。细胞经功能筛选后,无需转移即可在芯片原位进行细胞裂解与mRNA逆转录,并利用水浴条件完成反转录扩增。所有cDNA产物随后集中收集,并通过PCR引入chipcode标签进行文库构建,从而实现单细胞精度下的转录组测序与BCR重排(包括重链与轻链)解析。该平台不仅具备高重复性、低交叉污染、灵敏度高等优势,还特别适用于处理10–1000个稀有功能性免疫细胞,在样本有限或难以高通量富集的研究场景中具有显著优势。MoSMAR-seq成功将细胞功能筛选与基因表达、抗体序列三者联动起来,为免疫细胞的精准功能分类和单克隆抗体开发提供了强大技术支撑。
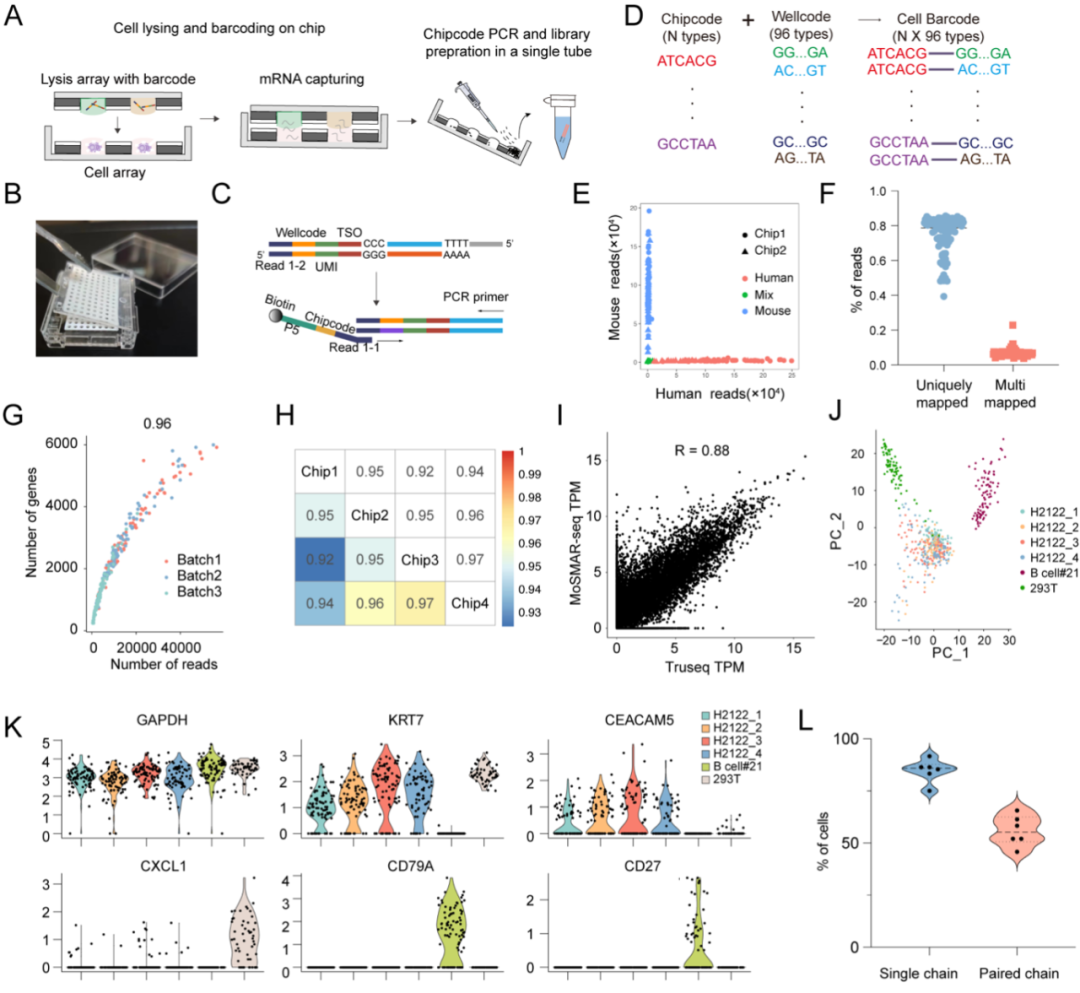
图4 MoSMAR-seq的实验流程及验证
在动物实验中,研究团队利用小鼠模型系统性评估了MoSMAR平台在识别骨髓中抗原特异性LLPCs的能力。研究选用腺病毒载体(AdC68)构建的新冠疫苗,对小鼠进行两剂次免疫,并分别在免疫后第9、12和36周采集骨髓样本。通过MoSMAR芯片对CD138⁺浆细胞进行筛选,团队从三只小鼠中共鉴定出322个Spike抗原特异性浆细胞,并成功克隆获得59株Spike结合抗体,其中有33株具备D614G病毒株中和活性。值得注意的是,这些中和抗体中多数来自发生了克隆扩增的谱系,且重链区体细胞高变率(SHM)显著高于此前报道的浆母细胞,提示这些LLPCs在迁移至骨髓前可能经历了更充分的亲和力成熟。通过进一步分析发现,部分中和抗体展示出良好的交叉结合能力,甚至能够有效识别BA.4/5、XBB及主流变异株JN.1,表现出广谱中和潜力。
为了进一步解析这些抗原特异性LLPCs的分子特征,研究团队结合MoSMAR-seq技术对筛选出的134个功能阳性浆细胞进行了单细胞转录组分析,并与公开数据库中超过千例的骨髓浆细胞数据整合比较。分析显示,这些Spike特异性LLPCs主要分布于终末分化状态的细胞亚群中,具有低Mki67和MHC II表达,表明其非近期分化形成,而是已经长期存活于骨髓微环境中。此外,团队还识别出多个在特异性LLPC中显著上调的功能基因(如Cd47、Cotl1、Rab5a等),并通过GO与KEGG富集分析揭示其在蛋白运输、免疫应答及Ig生成等通路中活跃表达,进一步支持其持续分泌抗体的功能状态。研究还发现,不同克隆型之间可能存在趋化因子(如CXCL12-CXCR4)与细胞因子(如IL-10)介导的细胞-细胞通讯,为进一步探索LLPCs在骨髓微环境中构建稳态的机制提供了初步线索。
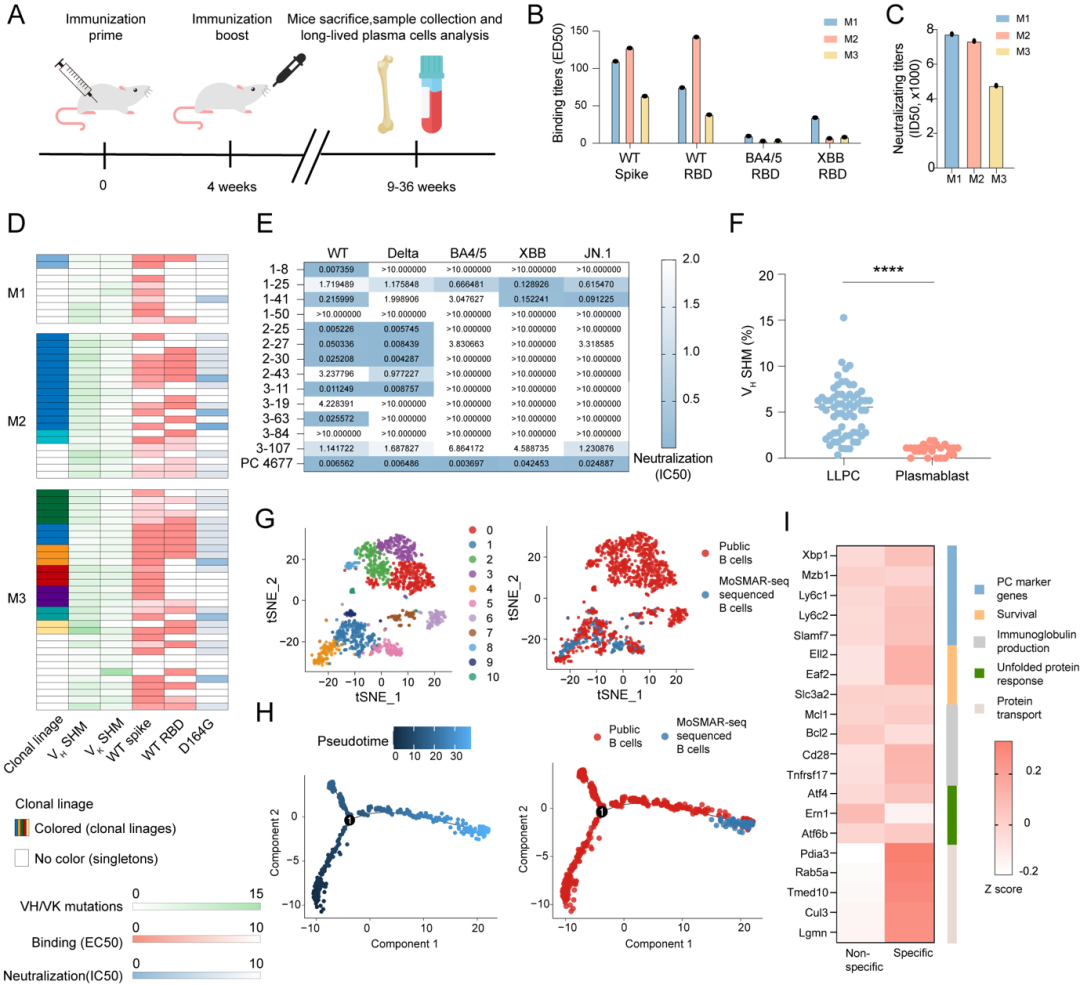
图5 通过MoSMAR平台评估免疫小鼠来源的LLPC衍生mAb及其SARS-CoV-2 Spike特异性LLPC的转录特征分析
刘鹏团队还与张林琦团队进行了多个项目的合作,成功将该平台应用于多个不同疫苗和抗体药物的研发项目中。利用此平台,研究团队成功从呼吸道合胞病毒疫苗(AdC68-DS2)免疫小鼠骨髓中分离鉴定出29种DS2特异性抗体,其中20种抗体展现出优异的病毒中和活性(IC50<5000 ng/mL)。研究发现,这些中和抗体主要靶向病毒pre-F蛋白的➢位点(55%)和II位点(25%),并表现出皮摩尔级的超高结合亲和力。特别值得关注的是,抗体mAb60展现出与已上市抗体药物Motavizumab相当的中和效力(IC50=35.6 ng/mL)。该成果不仅验证了MoSMAR平台在抗体发现领域的准确性和实用性,同时证实了AdC68-DS2疫苗可诱导强烈的保护性抗体反应,为基于结构设计的疫苗研发提供了新的技术路径和理论支撑[1]。
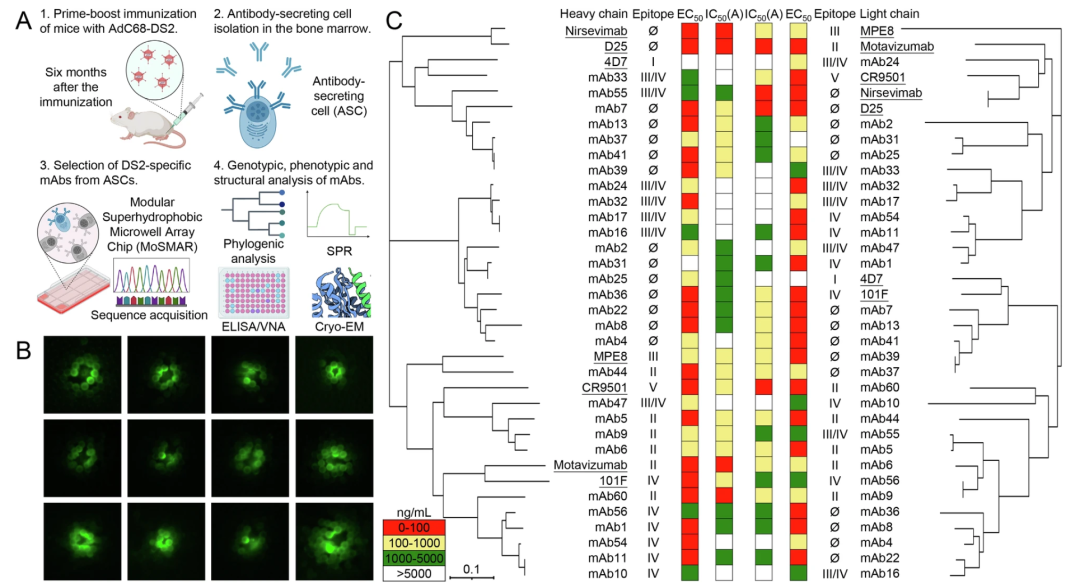
图6 基于MoSMAR平台筛选AdC68-DS2疫苗诱导的靶向➢位点和II位点的强效中和抗体
清华大学生物医学工程学院在读博士生赵添、基础医学院在读博士生雷雨晴和生物医学工程学院已毕业博士生刘畅为本文共同第一作者,清华大学生物医学工程学院刘鹏研究员和基础医学院张林琦教授为该论文通讯作者。研究得到了国家自然科学基金及国家重点研发计划等项目资助。