乙型肝炎病毒(HBV)是一种感染人肝脏细胞的DNA病毒,可导致一系列肝脏疾病,包括急性或慢性乙型肝炎、肝纤维化、肝硬化以及肝细胞癌。我国HBV携带者约7000万例,每年新增肝癌患者40万例左右,这其中84%携带HBV。慢性乙型肝炎患者对乙肝表面抗原(HBsAg)产生免疫耐受,这种免疫耐受使得接种传统的重组HBsAg(rHBsAg)疫苗无法有效诱导抗体和T细胞反应。长期以来,研发能打破这种免疫耐受状态的治疗性疫苗是领域内的重要挑战。在慢性HBV感染状态下,树突状细胞(DCs)的抗原递呈能力下降,而这些细胞在疫苗设计中是最重要的抗原呈递细胞。因此,将有效的免疫佐剂靶向至引流淋巴结中的抗原递呈细胞,可能是克服HBV免疫耐受有希望的策略。
近日,清华大学基础医学院傅阳心团队和中国科学院生物物理研究所彭华课题组在JCI Insight杂志发表了题为“Anti-PD-L1-IFN-α-adjuvanted HBsAg vaccine overcomes HBV immune tolerance through targeting both DCs and macrophages”的研究论文,开发了一种突破慢性乙型肝炎免疫耐受的创新疫苗策略。构建出一种新型anti-PD-L1-IFNα(aPD-L1-IFNα)融合蛋白靶向性佐剂,利用PD-L1在DCs和巨噬细胞上的表达显著高于其他细胞类型的特征,皮下注射后直接靶向引流淋巴结中的抗原递呈细胞,显著增强DCs和巨噬细胞的抗原摄取与呈递能力;将其作为佐剂与rHBsAg疫苗混合皮下免疫,在小鼠模型中成功打破了HBV诱导的免疫耐受,诱导出强烈的anti-HBsAg中和抗体以及特异性CD8+ T细胞反应,实现部分小鼠的功能性治愈。
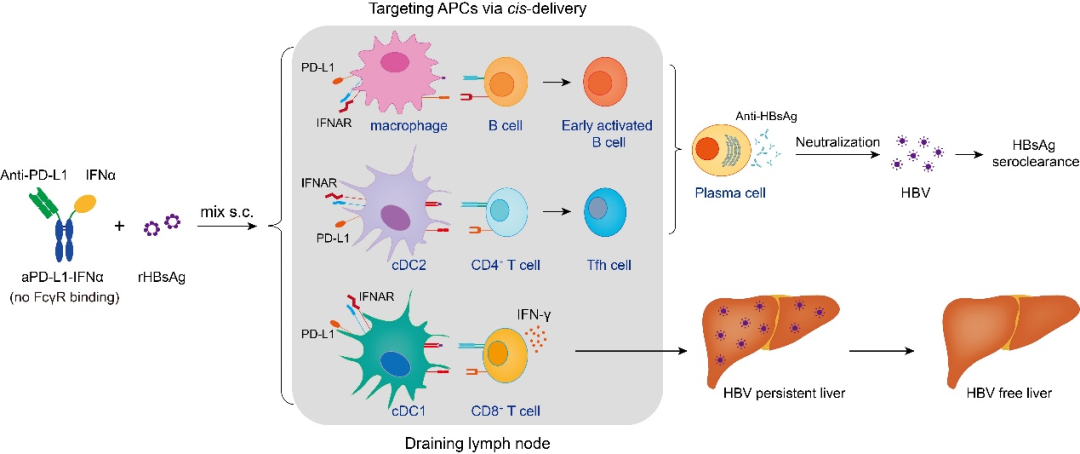
研究发现aPD-L1-IFNα发挥免疫效应依赖于引流淋巴结中DCs和巨噬细胞的协调作用:巨噬细胞负责早期B细胞的激活,启动抗体反应,DCs(尤其是cDC2亚群)则激活Tfh细胞辅助B细胞进一步活化为浆细胞分泌抗体中和血清中病毒;cDC1亚群激活CD8+ T细胞,分泌IFNγ,通过细胞裂解和非裂解的方式清除细胞内的病毒。此外,IFNAR1信号通路在DCs和巨噬细胞中对aPD-L1-IFNα的免疫激活作用至关重要。该研究揭示了aPD-L1-IFNα通过靶向淋巴结中的DCs和巨噬细胞打破HBV免疫耐受的机制,为开发新型疫苗佐剂提供了理论依据,从而为开发针对慢性乙型肝炎的治疗性疫苗提供了新的思路和新的策略。该策略与此前本团队开发的通过静脉注射高剂量融合蛋白靶向肝脏的治疗策略不同(Meng C-Y, et al. Gut. 2023),本研究采用低剂量皮下注射,并与铝佐剂的rHBsAg商业化疫苗直接混合使用,操作更简便、剂量更低、更易于临床转化。
分子肿瘤学全国重点实验室、清华大学基础医学院傅阳心教授和中科院生物物理研究所彭华研究员(现广州国家实验室研究员)为本文通讯作者。中科院生物物理研究所助理研究员孟朝阳和分子肿瘤学全国重点实验室、清华大学基础医学院副研究员梁永以及中科院生物物理研究所博士研究生徐龙鑫为本文共同第一作者。研究得到了国家自然科学基金、广州国家实验室重大项目和国家重点研发计划等基金的支持。
Meng C-Y, Liang Y, Xu L, et al. Anti-PD-L1-IFN-α-adjuvanted HBsAg vaccine overcomes HBV immune tolerance through targeting both DCs and macrophages. JCI Insight. 2025;10(23):e198097. Published 2025 Dec 8. doi:10.1172/jci.insight.198097
文章链接
https://insight.jci.org/articles/view/198097