近年来,肿瘤免疫治疗已成为癌症治疗的核心策略之一。以免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)为代表的疗法在某些免疫“热”肿瘤中取得显著疗效,但广泛临床数据表明,超过七成的患者对ICIs无明显应答,或在初期有效后出现快速耐药,尤其在肿瘤免疫原性不足、肿瘤微环境免疫抑制显著的“冷”肿瘤中疗效受限。这类患者缺乏足够数量与质量的肿瘤特异性T细胞,难以被免疫治疗有效激活。在这一背景下,治疗性癌症疫苗作为诱导“新生”T细胞的重要手段,受到广泛关注。治疗性癌症疫苗需精准识别并递送肿瘤抗原,激活高质量的CD8+和CD4+ T细胞,从而填补ICIs应答率低的关键空白。近年来,随着新抗原识别技术、新型疫苗平台、高效递送系统、创新性疫苗佐剂与联合免疫疗法的发展,治疗性癌症疫苗正迎来新一轮技术革新。
2025年7月9日,清华大学基础医学院傅阳心教授与梁永副研究员团队在《Cellular & Molecular Immunology》发表综述“Eliciting antitumor immunity via therapeutic cancer vaccines”,系统总结了治疗性癌症疫苗的发展,概述了不同肿瘤抗原类型的免疫原性和治疗潜力,同时讨论了疫苗平台的演变——从基于肽的疫苗到mRNA疫苗,并对下一代疫苗设计的关键和临床试验进行了深入讨论。
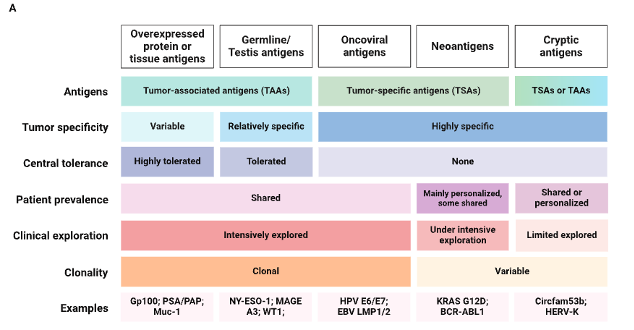
用于肿瘤疫苗设计的抗原选择
开发有效的肿瘤疫苗需要鉴定特定的肿瘤抗原,这些抗原在肿瘤组织中高度表达,并且能够引发强大的抗原特异性 T 细胞反应。肿瘤抗原大致分为肿瘤相关抗原(TAA)和肿瘤特异性抗原(TSA)。TAA 是在癌细胞中过表达的自身蛋白,包括组织特异性抗原和发育相关的种系/癌症睾丸抗原(germline/testis antigens)。虽然 TAA 是低肿瘤突变负荷患者的候选者并且无需额外鉴定,但其疗效受到免疫耐受、免疫原性差的限制,打破耐受需要考虑自身免疫的毒性问题。
TSA 是仅限于肿瘤的抗原,很少在正常组织中发现。它们可能来自基因改变(neoantigens)、参与致癌转化的致癌病毒(oncoviral antigens)。这些个性化的抗原可以规避免疫耐受。然而,并非所有鉴定出的新抗原都可以用于肿瘤疫苗,作者详细介绍了新抗原表位鉴定的策略和新抗原选择的考虑因素,包括MHC亲和力、抗原提呈、表达水平、肿瘤克隆性(clonality)、与自身肽的差异(self-dissimilarity)。最近,来源于非编码基因元件的隐蔽抗原(cryptic antigens)成为肿瘤疫苗的潜在靶点,例如内源性逆转录病毒元件(ERV)和环状RNA(circRNA),在多种癌症类型中共享。
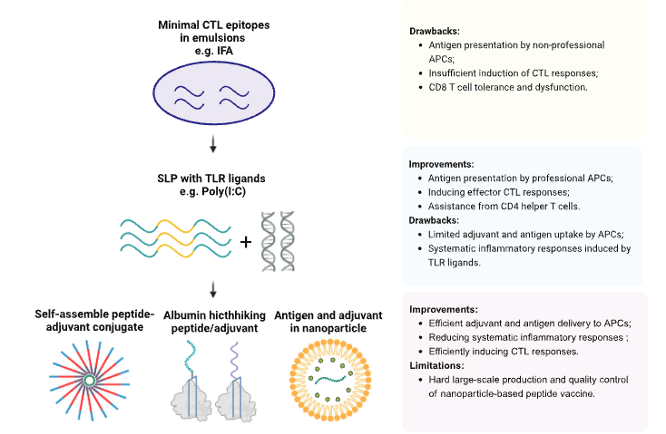
肿瘤疫苗平台
在疫苗平台方面,文章首先聚焦于近年来发展迅速的合成多肽疫苗。相较早期短肽疫苗,合成长肽(SLPs)能够被更有效地提呈,然而合成肽本身的低免疫原性需要额外的递送系统和佐剂来引发有效的抗原特异性免疫反应。目前,基于肽的肿瘤疫苗的研究集中在设计肽序列以增强其加工和APC的呈递,以及将它们与各种佐剂系统相结合以提高其免疫原性。下一代肽疫苗旨在开发递送系统,例如基于脂质或白蛋白(albumin hitchhiking)的载体,将肽和佐剂特异性地靶向到淋巴组织的APC。同时作者也指出,基于脂质颗粒的新抗原肽疫苗的临床应用面临着新抗原肽的不同化学性质导致包封率改变的问题。
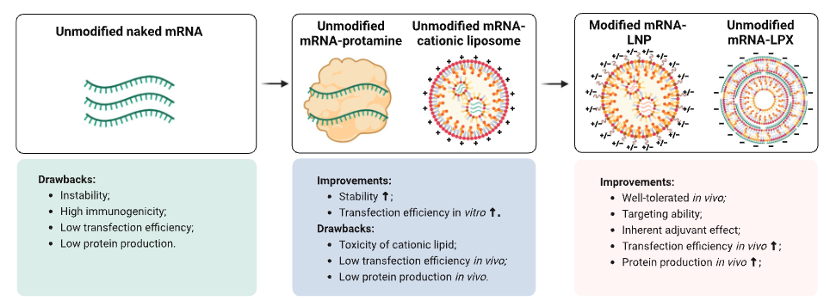
mRNA疫苗凭借其设计灵活、同时编码多个抗原表位、表达效率高等优点,成为当前最受关注的肿瘤疫苗平台之一。目前常用的mRNA疫苗递送系统包括LNP和LPX脂质纳米颗粒,它们具有不同的性质和器官靶向性。纳米颗粒的直径、电荷和分子组成是决定不同载体组织分布和细胞靶向的关键因素。脂质纳米颗粒和 mRNA 都可以作为有效的佐剂发挥作用,刺激多种先天免疫受体,从而支持适应性免疫的启动和维持。下一代mRNA疫苗聚焦于优化 LNP 配方以提高递送效率和免疫调节功能,设计 mRNA 结构元件以最大限度地提高蛋白质表达,以及加入编码新型疫苗佐剂的 mRNA 以增强适应性免疫,如IL12、IL27。然而,先天免疫系统的激活是一把双刃剑,由于癌症中的免疫抑制机制和次优的T细胞激活,疫苗接种需要强大的先天免疫激活才能产生有效的T细胞反应,然而先天免疫系统也会同时导致mRNA的降解。因此,mRNA疫苗的设计需要协调先天免疫和适应性免疫以达到最佳的治疗效果。在临床方面,肿瘤mRNA 疫苗的开发令人鼓舞,一些临床结果已进入 III 期。
给药途径
给药途径显着影响不同肿瘤疫苗的先天性和适应性免疫反应,选择合适的给药途径至关重要,常见的给药途径包括肌肉、皮内、皮下和静脉注射。给药途径的选择依赖于递送系统,如mRNA-LNP通常为肌肉注射,而mRNA-LPX为静脉注射。给药途径显着影响纳米颗粒的器官分布、靶向的免疫细胞类型、抗原表达的动力学以及由此产生的局部或全身免疫反应。
未来展望
在抗原鉴定、递送平台和免疫佐剂策略进步的推动下,肿瘤疫苗的研究前景越来越广阔。未来的研究可以通过NSG和质谱技术鉴定患者共有的新抗原,源于基因组的非编码和“暗物质”区域,以及非经典翻译过程。免疫抑制性 TME 对疫苗诱导的肿瘤 T 细胞的浸润、激活、增殖和效应功能构成重大障碍,将癌症疫苗与其他免疫调节疗法相结合可能有助于克服这些障碍并实现最佳肿瘤控制。此外,确定预测性生物标志物以选择对癌症疫苗治疗有反应的患者也很重要。除了基于肽和 mRNA 的癌症疫苗外,其他几种用于癌症免疫治疗的疫苗平台,包括 DC 疫苗、原位疫苗、基于病毒载体的疫苗和基于细菌的疫苗也受到广泛的关注。
分子肿瘤学全国重点实验室、清华大学基础医学院傅阳心教授和梁永副研究员为本文通讯作者。清华大学基础医学院博士生彭琨、赵晓雪为本文共同第一作者。研究得到了国家自然科学基金、科技部重点研发计划等基金的支持。
原文链接:
https://www.nature.com/articles/s41423-025-01316-4