在肿瘤免疫治疗持续革新的当下,如何精准唤醒肿瘤微环境中的免疫反应,尤其是激活肿瘤内树突状细胞(DC)与T细胞的协同作用,仍是一项重要挑战。2025年7月1日,清华大学基础医学院傅阳心团队和昌平实验室/北京大学刘志博团队合作在Nature Communications期刊背靠背发表了两篇论文,分别为:“ Single Atom Engineering for Radiotherapy-Activated Immune Agonist Prodrugs ”和“ Orchestrating Intratumoral DC-T Cell Immunity for enhanced Tumor Control via Radiotherapy-activated TLR7/8 prodrugs in mice ”。两篇论文分别从前药分子开发技术和内在激活机制方面共同阐述了一种创新性免疫策略:通过放疗响应药物(Radiotherapy-Activated Prodrug, RAP)精准激活TLR7/8通路,从而在肿瘤局部诱导强劲的免疫反应,避免系统毒副作用,进一步实现远端肿瘤的协同清除。


放疗响应的免疫激动剂前药开发:单氧原子工程化的RAP技术
刘志博课题组面向临床联合放化疗减毒增效的需求,致力于开发放疗响应药物技术(Angew 2020, JACS 2022, Angew 2022, Nat. Chem. 2024, Nat. Biomed. Eng. 2024, ACS Cent. Sci. 2024, Sci. Bull. 2024)。本次背靠背发表的第一篇论文起源于刘志博课题组2022年发展的新化学:活体内放疗驱动的氮氧化物(N-oxide)脱氧反应。其反应机制是利用放疗辐解水产生的水合电子(e⁻ₐq)介导氮氧化物的脱氧,而该反应的底物是芳香三级胺以及芳香氮杂环类化合物,占近十年FDA批准药物结构的80%以上。因此,作者通过计算机辅助的药物设计分析、筛选含喹啉等基团的药物分子,构建单个氧原子工程化的放疗响应前药分子(SAE-RAP),利用氧原子对药物活性基团“上锁”,此后在肿瘤内通过放疗照射“解锁”恢复药物活性。针对先天免疫重要激活分子TLR7/8激动剂咪唑喹啉类化合物(IMDQ)存在的毒副作用问题与靶向递送需求,作者应用SAE-RAP平台技术开发了一系列放疗响应的小分子TLR7/8激动剂前药(例如:O-R848),EC50值可提高4000倍以上使其在进入体内后处于“沉默”状态。在临床前荷瘤小鼠模型上,系统给药之后的肿瘤局部放疗可以将高效释放激动剂原药,引起肿瘤消退并抑制未辐照远端肿瘤的生长。通过这种“系统给药+局部激活”的新颖方式,TLR7/8激动剂被精确激活于肿瘤局部,避免了全身毒性的发生,有望突破以往免疫激动剂使用中的“疗效-毒性”矛盾。此外,SAE-RAP平台技术后续可针对多种靶点开发高原子经济性的放疗响应药物,为临床放射联合化疗/免疫治疗提供降毒增效的新对策。
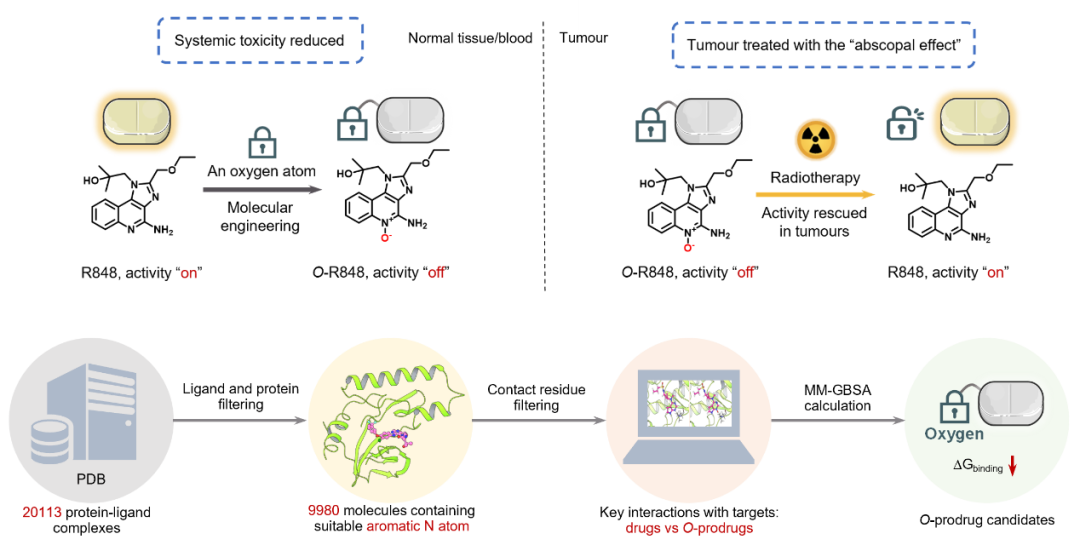
激活肿瘤内DC-T细胞轴,构筑局部免疫堡垒
放疗激活平台为探究肿瘤内的免疫反应提供了创新性的技术支持,因此,第二篇论文重点解析肿瘤内DC-T细胞轴的免疫反应及其对肿瘤治疗的内在机制。在此项工作中,作者利用RAP技术修饰阻断TLR7/8激动剂-咪唑喹啉类化合物IMDQ的活性,从而探究其对肿瘤局部的激活作用。研究显示,放疗激活后产生的IMDQ激动剂能够有效激活肿瘤内的树突状细胞(cDCs),进而增强其抗原呈递功能,促进肿瘤浸润性T细胞(TILs)增殖与活化。值得关注的是,这种免疫激活效应并非依赖引流淋巴结中新T细胞的招募,而是依靠肿瘤内部既有T细胞的重新赋能,这一发现进一步强调了局部免疫激活的核心地位。
进一步机制研究揭示,STING和MyD88信号通路协同调控了I型干扰素的产生,从而驱动DC介导的T细胞激活,形成以肿瘤微环境为中心的免疫循环。这一发现不仅深化了我们对肿瘤内免疫调控机制的理解,也为后续靶向免疫通路的精准干预提供理论基础。
低剂量分次放疗+前药,激发“远端抗肿瘤效应”(abscopal effect)
长期以来,实现放疗联合免疫治疗的“远端抗肿瘤效应”一直是临床难题。高剂量放疗虽能清除原发肿瘤,却可能损伤TILs;而低剂量放疗则常难以激活足够免疫反应。在本研究中比较不同放疗方案后发现,只有低剂量分次放疗(如4 Gy ×3 或 6 Gy ×3)能够在不损伤TILs的前提下有效激活RAP,诱导原位瘤控制及远端肿瘤抑制。这一观察提示:适度、精准的放疗剂量调控,对于维持肿瘤微环境中的免疫活性具有重要意义,也为免疫协同放疗提供了实验依据。
革新肿瘤免疫策略,为“冷肿瘤”提供新希望
在多种小鼠模型中,该策略均表现出优异的抗肿瘤效果与良好的生物安全性,不仅有效抑制原发灶,还能减少远端转移,显著重塑肿瘤微环境。研究团队表示,这一放疗激活免疫前药的策略在理论上为肿瘤局部免疫激活机制提供了新视角,在实践中也为联合治疗策略提供了潜在的转化平台。未来,该策略有望与抗体、mRNA疫苗、CAR-T疗法等组合,进一步提升系统性抗肿瘤免疫的广度与深度。
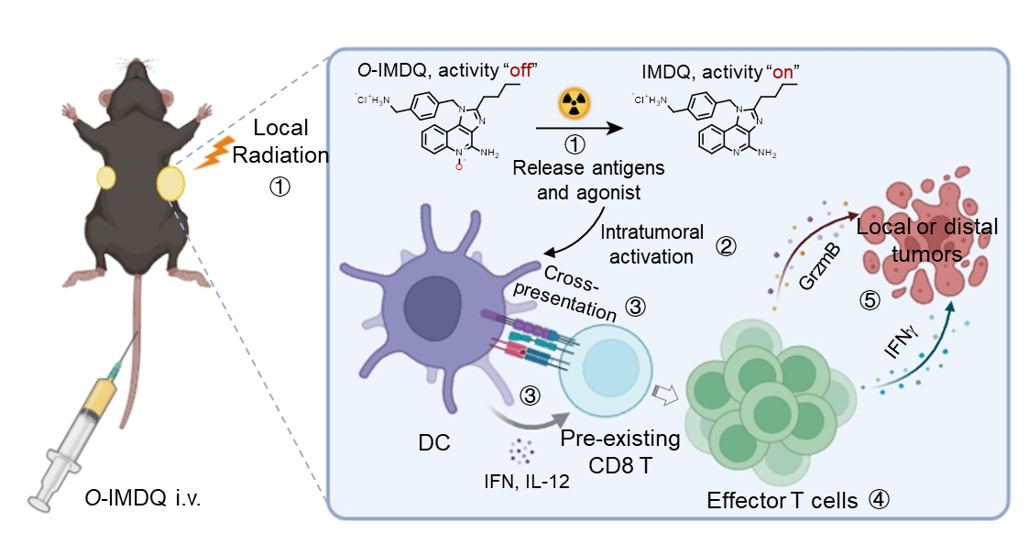
综上,两项研究以RAP技术为起点、以精准免疫激活为核心,探索了放疗引导下局部免疫“点火”机制,成功构建出兼具疗效与安全的新型抗肿瘤策略。通过激活TME中DC-T细胞轴,RAP策略有望成为放疗与免疫治疗协同进展的重要支点,也为提升当前肿瘤治疗的精准性与有效性提供了值得关注的新方向。
以上两项研究的通讯作者是清华大学基础医学院傅阳心教授和昌平实验室/北京大学化学与分子工程学院刘志博教授。清华大学尹晓哲博士、昌平实验室副研究员丁泽轩博士为两篇文章的共同第一作者,另外清华大学余莉博士和北京大学博士生郑越丹、李奕言也分别为两篇文章的共同第一作者。
原文链接:
https://doi.org/10.1038/s41467-025-60769-3
https://doi.org/10.1038/s41467-025-60768-4