环状鸟嘌呤核苷酸腺嘌呤核苷酸合成酶 (Cyclic GMP-AMP synthase, cGAS) 是一种在天然免疫信号通路中起到重要作用的模式识别受体 (pattern recognition receptor, PRR) 。胞质中cGAS识别双链DNA(dsDNA)分子,并且被dsDNA激活后催化合成信使分子2’, 3’-cGAMP,其随后激活天然免疫通路中的重要接头分子STING (stimulator of interferon genes, 干扰素基因刺激因子)。STING结合2’, 3’-cGAMP后激活并介导转录因子IRF3的磷酸化,最终引起I型干扰素的表达。
cGAS的激活及活性受到很多因素的调节,比如泛素化、SUMO化、磷酸化和谷氨酸化(Hu et al, 2016; Seo et al, 2015; Wang et al, 2017; Xia et al, 2016)等。除此之外,病毒编码的基因也能对cGAS的活性进行调节(Li et al, 2016)。清华大学医学院向烨团队与山东大学基础医学院朱德裕团队发现RNA通过影响cGAS相分离对cGAS的活性具有调节作用,相关研究于2022年11月16日在EMBO reports上在线发表,所发表论文题为Regulation of cGAS activity by RNA-modulated phase separation。
在之前研究中,美国得克萨斯州西南医学中心的陈志坚课题组发现dsDNA引起cGAS发生相分离并激活cGAS, RNA也能引起cGAS发生相分离但不激活cGAS(Du & Chen, 2018)。向烨-朱德裕团队发现RNA能在体外引起cGAS发生相分离但不激活cGAS。在细胞质中存在大量的RNA分子,包括tRNA,mRNA等。这些胞质中的RNA分子与cGAS形成了复合物,同时当转染的外源dsDNA分子在胞质中引起cGAS发生相分离时,能观察到RNA、dsDNA与cGAS三者共定位。体外实验表明,RNA、dsDNA与cGAS三者形成相分离,且RNA与dsDNA处于动态平衡状态。随着dsDNA浓度的提高,相分离液滴中的RNA能逐渐被dsDNA取代;反之亦然,当RNA浓度提高时,相分离液滴中的dsDNA能逐渐被RNA取代。体外活性实验表明,dsDNA浓度较高时,RNA的存在抑制了cGAS的活性,然而dsDNA浓度较低时,RNA能提高cGAS的活性。在对此现象发生的原因进行深入探究后发现,dsDNA浓度较高时,dsDNA能高效介导cGAS相分离的形成,而RNA能与相分离液滴中的dsDNA发生竞争,使dsDNA被挤出到相分离液滴之外从而抑制cGAS活性;而dsDNA浓度较低时,dsDNA不能有效介导cGAS相分离及激活cGAS,此时RNA能帮助介导cGAS的相分离,同时dsDNA能进入到cGAS相分离液滴当中激活cGAS。这很好的解释了胞质内RNA调节cGAS活性的机理。细胞功能实验表明,将 RNA与低剂量的dsDNA共同转染到THP1细胞中,干扰素β的表达水平显著提升(与对照相比提升~20倍);而将RNA与较高剂量的dsDNA共同转染到THP1细胞中,干扰素β的表达水平变化不明显;继续增加dsDNA的剂量可能会出现RNA引起干扰素β的表达水平受到抑制,但此时细胞会容易因转染发生死亡。加入cGAS抑制剂G150后,干扰素β表达水平提升现象消失,这些数据综合表明细胞内RNA通过调制cGAS-dsDNA相分离过程调节cGAS的活性(图1),而这一调节机制在cGAS-STING通路中很可能起到关键作用,其能提升机体感知微量病原感染的敏感性,同时避免机体在大量病原感染时过度激活天然免疫反应。
清华大学医学院向烨,山东大学基础医学院朱德裕为该论文的共同通讯作者,向烨课题组陈思炼博士与荣苗博士为该论文的共同第一作者。该项目研究获得国家自然科学基金,科技部重点研发计划,清华大学万科基金,北京市生物结构前沿研究中心等项目资金支持。
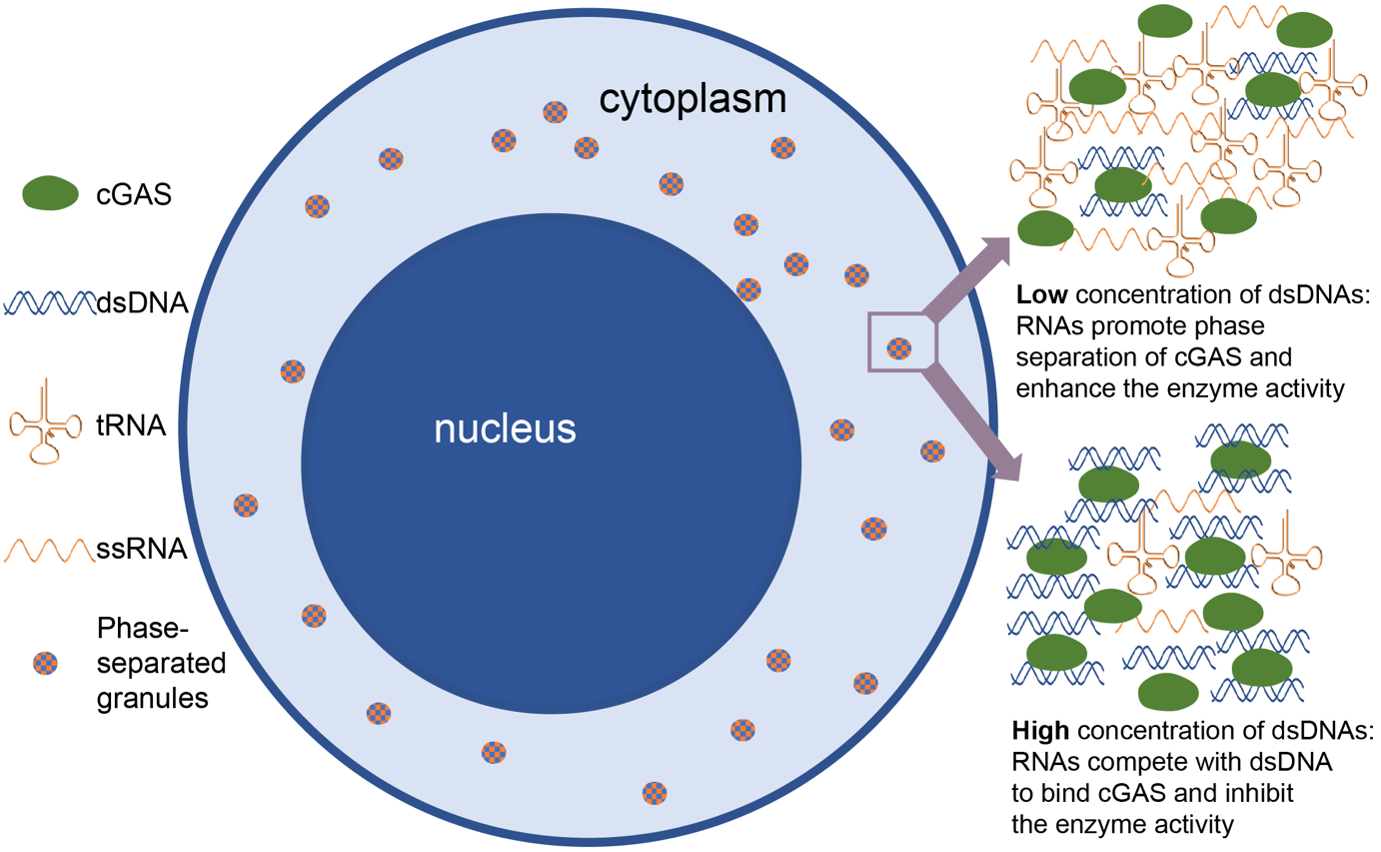
图1. RNA调节cGAS相分离及活性
参考文献:
1、Du M, Chen ZJ (2018) DNA-induced liquid phase condensation of cGAS activates innate immune signaling. Science 361: eaat1022
2、Hu MM, Yang Q, Xie XQ, Liao CY, Lin H, Liu TT, Yin L, Shu HB (2016) Sumoylation Promotes the Stability of the DNA Sensor cGAS and the Adaptor STING to Regulate the Kinetics of Response to DNA Virus. Immunity 45: 555-569
3、Li W, Avey D, Fu B, Wu J-j, Ma S, Liu X, Zhu F (2016) Kaposi's Sarcoma-Associated Herpesvirus Inhibitor of cGAS (KicGAS), Encoded by ORF52, Is an Abundant Tegument Protein and Is Required for Production of Infectious Progeny Viruses. J Virol 90: 5329-5342
4、Seo GJ, Yang A, Tan B, Kim S, Liang Q, Choi Y, Yuan W, Feng P, Park HS, Jung JU (2015) Akt Kinase-Mediated Checkpoint of cGAS DNA Sensing Pathway. Cell Rep 13: 440-449
5、Wang Q, Huang L, Hong Z, Lv Z, Mao Z, Tang Y, Kong X, Li S, Cui Y, Liu H et al (2017) The E3 ubiquitin ligase RNF185 facilitates the cGAS-mediated innate immune response. PLoS Path 13: e1006264
6、Xia P, Ye B, Wang S, Zhu X, Du Y, Xiong Z, Tian Y, Fan Z (2016) Glutamylation of the DNA sensor cGAS regulates its binding and synthase activity in antiviral immunity. Nat Immunol 17: 369-378