2025年7月31日,清华大学药学院秦为课题组在美国化学会期刊ACS central science上发表了题为“Precise and in vivo-compatible spatial proteomics via bioluminescence-triggered photocatalytic proximity labeling”的文章。该研究开发了一种基于生物发光共振能量转移(BRET)的新型邻近标记技术,该方法有精准的标记半径,并兼具活体环境的适用性。

研究背景
细胞内蛋白质之间的相互作用构成了维系生命活动的基本网络。这些蛋白质常以稳定或动态的方式组装于特定的亚细胞区域,形成具有功能特异性的“亚细胞社群”,共同参与细胞的代谢、信号转导、应激响应等多种关键过程。以哺乳动物细胞为例,细胞内部高度区室化,不同蛋白在空间上呈现动态分布。例如,在应激颗粒(stress granules, SGs)等无膜细胞器中,大量蛋白可被招募进入,并根据其结合亲和力和动力学行为被划分为“核心”与“外壳”蛋白,构成凝聚体结构。这些复杂的亚细胞结构对蛋白质功能的实现和调控具有重要意义。
空间蛋白质组学被Nature methods杂志评选为2024年的年度技术,邻近标记(Proximity Labeling, PL)技术在空间蛋白质组学中显示出独特优势。其中,光催化邻近标记通过外源光照激活光催化剂触发标记反应,具有很高的时间分辨率,为捕捉快速、动态的蛋白互作事件提供了全新路径。该技术通常将HaloTag与靶蛋白融合,通过HaloTag连接光催化剂,从而实现遗传编码的靶蛋白邻近标记解析。然而,外源光照除了可以激活HaloTag上偶联的光催化剂,同样也会激活细胞里游离的光催化剂,包括FMN(黄素单核苷酸)等内源光敏小分子,从而带来较高的非特异标记。同时,可见光照射也会带来较大的细胞毒性,影响正常生理功能。更为重要的是,可见光的组织穿透力较差,因此限制了光催化邻近标记在活体动物中的应用。因此,亟需开发低背景、低毒性和活体兼容的光催化邻近标记技术,推动其在活体生物学体系中的时空蛋白质组学应用。
研究内容
为克服以上挑战,秦为课题组开发了新型光催化邻近标记技术——BRET-ID(图1),该技术利用荧光素酶NanoLuc在细胞内产生生物源光,并通过生物发光共振能量转移(BRET)效应激活相邻遗传编码的光催化剂,而游离的光敏小分子则因为距离效应无法被激活,克服了其带来的非特异标记和毒性问题。同时,NanoLuc及其底物furimazine已经被证明在活体成像中具有广泛应用性,它取代外源光照后也将赋予光催化邻近标记以活体兼容性。
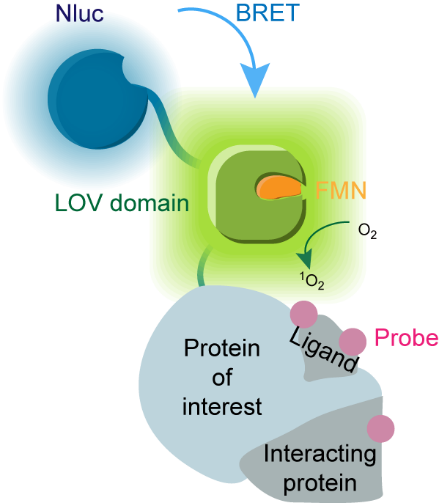
图1. BRET-ID示意图
团队首先利用BRET-ID技术对内质网膜(ERM)进行空间蛋白质组学分析,证明了其高空间特异性与低标记背景。相比于蓝光激活的光催化标记,BRET-ID在无空间对照的条件下即可实现精准标记,显著减少细胞质非特异性蛋白的假阳性,避免内源光敏剂诱导的广泛背景信号。BRET-ID富集的蛋白更集中于ERM及其相关膜结构,而蓝光标记方法中富集的蛋白则大多数是胞质蛋白(图2)。
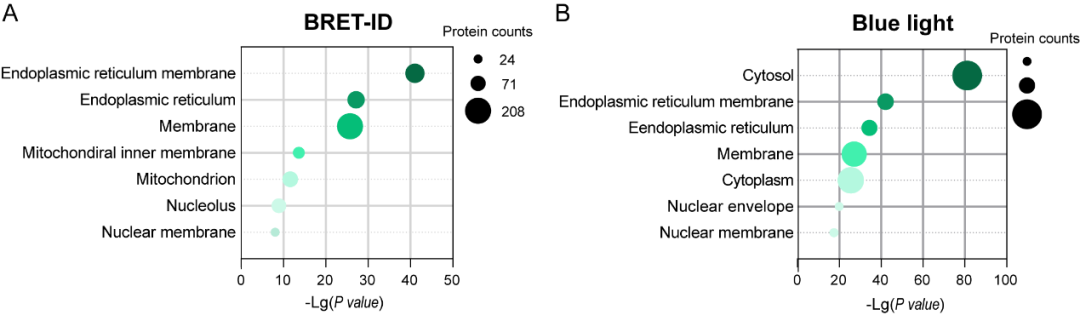
图2. 基于BRET-ID(A)和蓝光照射(B)方法获得的ERM蛋白质组的GO分析
同时BRET-ID的标记仅在1-5分钟的furimazine处理中即能完成,此时间分辨率可以很好地应用于动态、瞬时的相互作用解析,因此我们将其应用于解析μ-opioid(hMOR)内吞过程中的蛋白互作时空动态。通过对hMOR在配体刺激下的1分钟标记,成功捕捉到其内吞过程中的短暂互作蛋白。同时,我们绘制了应激颗粒形成过程中的高时空分辨蛋白质组图谱,展现了极高的应激颗粒空间特异性。其中发现了mTORC2关键组分RICTOR在氧化压力下被招募至SG,我们通过成像实验对此现象进行了验证,并发现RICTOR抑制剂可以显著抑制SG的形成。以上结果表明BRET-ID可在不依赖外源光源或复杂对照条件下,精准标记蛋白相互作用网络,适用于解析复杂动态蛋白互作和应激动态中的关键蛋白事件。
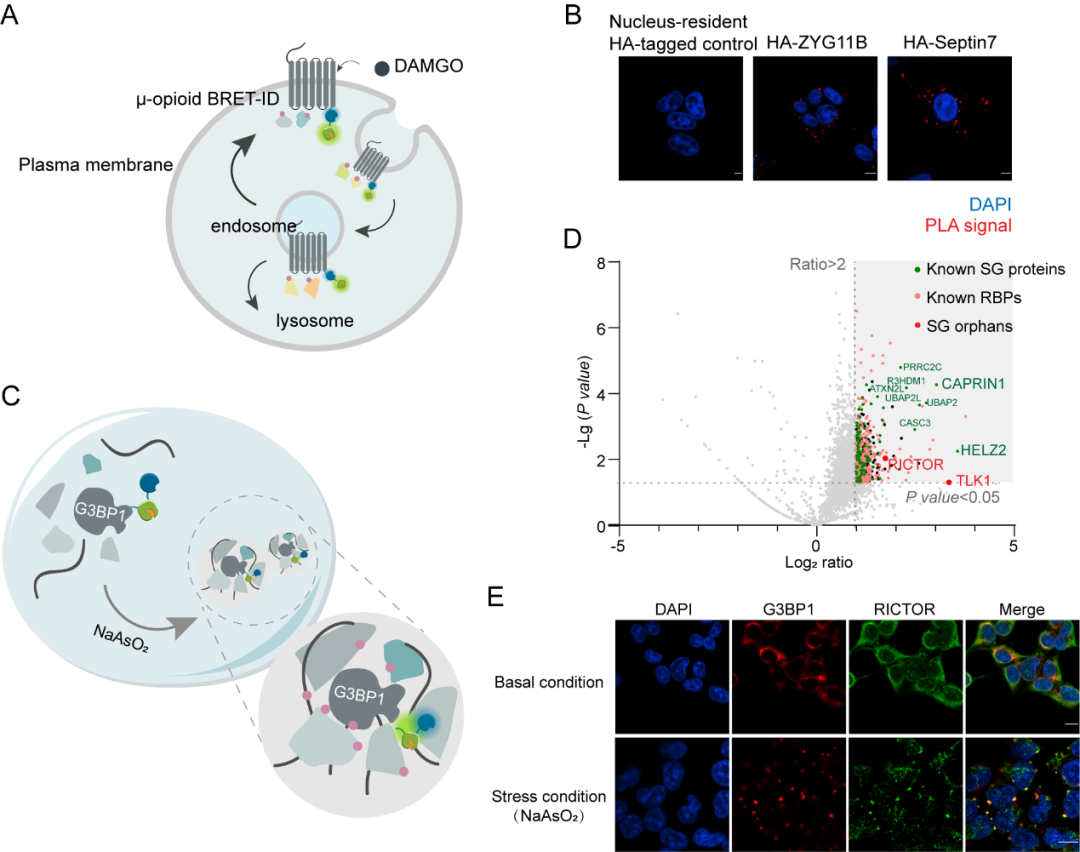
图3.(A)BRET-ID标记示意图,用于在DAMGO诱导的内吞作用期间绘制hMOR相互作用蛋白 (B)BRET-ID鉴定到的hMOR相互作用蛋白的PLA验证 (C)BRET-ID标记示意图,用于SG蛋白组的绘制 (D)BRET-ID鉴定到的压力条件下SG蛋白图谱 (E)成像验证鉴定得到的蛋白与SG的共定位
为了验证BRET-ID的活体兼容性,我们在小鼠肿瘤模型中进行了标记实验,首次描绘了G3BP1在活体环境下的互作图谱。共鉴定出268个显著富集蛋白,涵盖多个相分离能力强的RNA结合蛋白,显示出与体外数据的显著差异,强调了体内邻近标记对解析病理状态下蛋白网络的独特价值。同时,NanoLuc的生物发光适用于活体成像,因此BRET-ID具备实现在活体动物中靶蛋白的同时成像和标记。
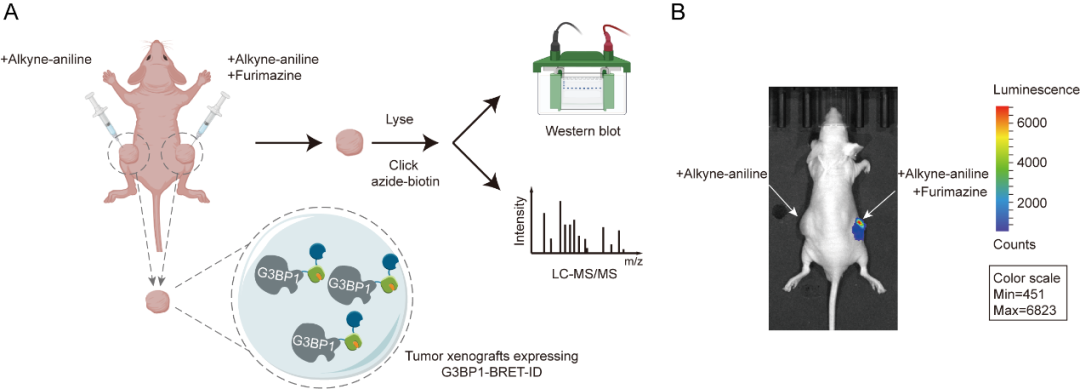
图4.(A)BRET-ID标记示意图,用于绘制体内G3BP1的相互作用蛋白 (B)小动物荧光成像显示BRET-ID在体内保持活性
致谢
清华大学药学院秦为助理教授为本文的通讯作者。清华大学药学院刘翔宇副教授、储凌副教授为本文提供了重要帮助。清华大学药学院博士生孙雪歌、博士后张艳玲、科研助理陆文捷和博士生郭弘扬为本文的共同第一作者。清华大学药学院博士后何国栋、博士生罗思远对本文提供了重要实验帮助。本研究得到了国家重点研发计划、国家自然科学基金、清华大学“笃实计划”等基金的资助支持。
科学家小档案

秦为博士2014年本科毕业于北京理工大学生命学院,2019年毕业于北京大学前沿交叉学院,获博士学位。博士期间师从北京大学化学与分子工程学院王初教授和陈兴教授,发展了一系列化学蛋白质组学策略研究O-GlcNAc糖基化修饰和衣康酸修饰。2019年到2023年在美国斯坦福大学从事博士后研究工作,合作导师为著名化学生物学家Alice Y. Ting教授, 从事邻近标记等化学生物学研究。在此期间发展了具有时空分辨率的功能性邻近标记技术,实现亚细胞区域内特定蛋白类型的大规模分析。同时发展了针对蛋白质空间动态转运的新型邻近标记技术TransitID,并利用该方法首次实现了细胞内不同细胞器之间以及细胞细胞之间蛋白转运的大规模分析。秦为博士于2023年3月加入清华大学药学院展开独立研究,研究方向为发展化学生物学和蛋白质组学技术,以及探索宿主病原体相互作用界面中生物大分子的动态修饰和相互作用。
课题组长期招聘化学生物学,神经生物学,生物信息学,有机化学等交叉学科博士后。有意者邮件联系weiqin@tsinghua.edu.cn