2022年6月27日,清华大学医学院祁海教授和张林琦教授受邀在Nature Immunology(《自然·免疫学》)杂志发表了题为The humoral response and antibodies against SARS-CoV-2 infection(《新型冠状病毒感染的体液免疫应答和抗体》)的综述。文章全面系统总结了新型冠状病毒感染者的体液免疫过程,以及病毒感染或疫苗诱导机体产生的中和抗体的关键特征,并展望了诱导新冠变异株广谱中和抗体的疫苗设计策略。
2019年底以来,新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)在世界各地广泛传播,造成了新型冠状病毒肺炎(corona virus disease 2019, COVID-19)大流行。据世界卫生组织报道,截止6月26日全世界SARS-CoV-2感染数字超过5.4亿人次,超过600万人死于COVID-19。从疫情暴发初期,为高效遏制新冠病毒的广泛传播,科学家们对SARS-CoV-2的致病机理及机体的抵御机制进行了大量研究。不仅对先天性免疫和获得性免疫过程有了更清晰的认识,也为治疗COVID-19和开发疫苗提供了潜在的靶点和策略。其中,诱导产生保护性抗体阻断病毒感染、复制和传播,既是机体抵御SARS-CoV-2的关键机制,也是疫苗发挥功能的重要方式。该综述对SARS-CoV-2感染和疫苗接种后机体的体液免疫(humoral response)过程及产生的中和抗体(antibody)特征进行了全面的分析和总结。
大量研究表明,与其它呼吸道冠状病毒引起的体液免疫应答相似,机体感染SARS-CoV-2后1周左右,在血清中开始出现特异性识别SARS-CoV-2的IgM, IgA和IgG等多种类型的抗体反应,并展示一定程度的中和能力;3~4周后,抗SARS-CoV-2的中和抗体量达到峰值;之后IgG抗体水平在峰值维持几个月,而IgM和IgA水平逐渐下降。如图1所示,抗原特异性B细胞被激活后,一部分在滤泡区外(extrafollicular, EF)分化成为短寿命浆细胞(short-lived plasma cell),快速分泌具一定中和能力的抗体,抑制SARS-CoV-2在体内扩散;另一部分则回到滤泡区分化成为生发中心(germinal center)B细胞,经过筛选和克隆增殖后最终分化成为长寿命浆细胞(long-lived plasma cells)。这些长寿命浆细胞多数定居在骨髓中,能够分泌具有较强中和能力的抗体,并维持适当的水平,协助机体有效控制SARS-CoV-2的复制。虽然这两个过程均会产生记忆B细胞(memory B cell),但生发中心反应来源的记忆B细胞存活时间更长,并且表达的B细胞受体(B cell receptor, BCR)结合和中和病毒能力更强,与长寿命浆细胞一起建立体液免疫记忆,有效抵御SARS-CoV-2的再次感染。除血清外,IgA型中和抗体还会分布在包括鼻黏膜等病毒侵入途经的呼吸道黏膜组织中,对抵御再次感染或减轻感染症状有重要意义。此外,尽管SARS-CoV-2和其它人源冠状病毒序列相似度不高,但感染产生的抗体仍会发生相互的交叉反应(cross-reactivity),一定程度上识别并中和SARS-CoV-2,抵御感染。
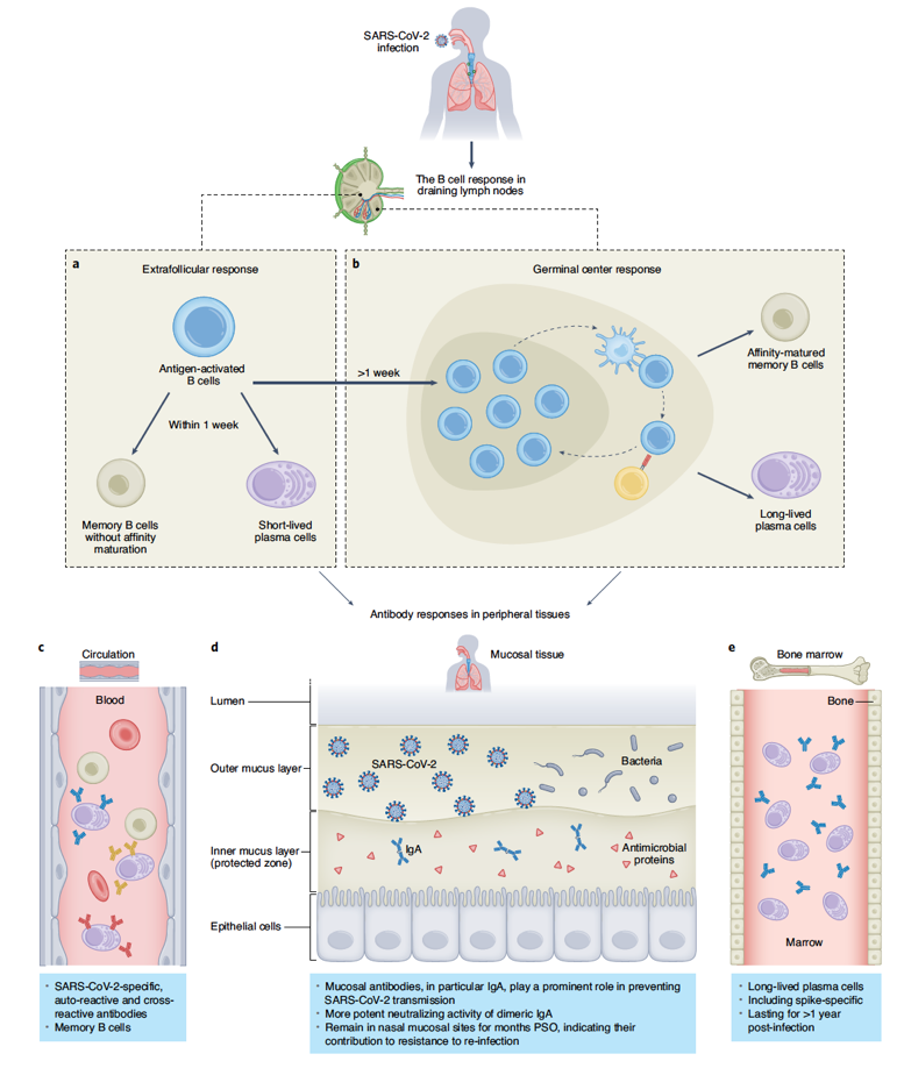
图1. 针对SARS-CoV-2感染的B细胞和抗体免疫应答
随后,文章进一步总结了识别SARS-CoV-2表面刺突蛋白(spike glycoprotein, S蛋白)抗体的中和能力和广谱能力。包被在病毒表面的S蛋白是中和抗体的主要识别位点。如图2,S蛋白有S1和S2两个功能区,S1由N端结构域(N-amino-terminal domain, NTD)和受体结合域(receptor-binding domain, RBD)等四种结构域构成,与宿主细胞受体ACE2结合;而S2则介导病毒和细胞膜的融合,完成病毒遗传物质向胞内释放。中和抗体主要通过竞争性结合RBD来抑制SARS-CoV-2的感染和扩散。目前流行的SARS-CoV-2变异株的大部分突变都集中在包含RBD和NTD的S1功能区,增强了新冠病毒对抗体药物和疫苗的逃逸能力。
能够结合RBD的中和抗体主要分为7类(RBD-1~RBD-7),主要识别顶部面(top face)、外表面(outer face)和内表面(inner face)。其中识别顶部面的主要是RBD-1~RBD-3。这三类中和抗体的结合位点高度重合,但各自有特定的结合方式,保证了高特异性和强结合力。但正是由于高强度识别和结合,导致多种变异株的出现,从而逃逸这几类抗体的中和作用。RBD-4和RBD-5两类主要识别RBD的外表面,也是目前最广谱、结合能力最强的中和抗体。但它们也存在和RBD-1~3一样的问题,即变异发生在S蛋白与抗体结合的表位区域时,直接导致活性降低和病毒逃避。RBD-6和RBD-7两类主要是结合RBD内表面的抗体,通常情况下在RBD是向上构象时才能结合其内部的表位,中和能力相对较弱。而奥密克戎(Omicron)变异株BA.1和BA.2在这两类抗体结合的位点都发生了突变,导致大部分RBD-6和RBD-7丢失中和能力。
除了识别RBD的中和抗体之外,结合NTD的抗体也具有一定的中和能力。根据结合的位置不同,NTD抗体大概分为三类,即NTD-1, NTD-2和NTD-3,其中NTD-1类抗体结合在NTD的顶部(top side),NTD-2类抗体结合在NTD的前侧(front side),NTD-3类抗体则结合在靠近RBD的左侧(left side)。与RBD抗体比较,NTD抗体中和能力较弱,大多数识别病毒蛋白三维空间构象,在突变株的NTD区域,有大量的氨基酸缺失和插入,以及众多的点突变,其中大部分都可以逃逸NTD抗体的识别和中和。
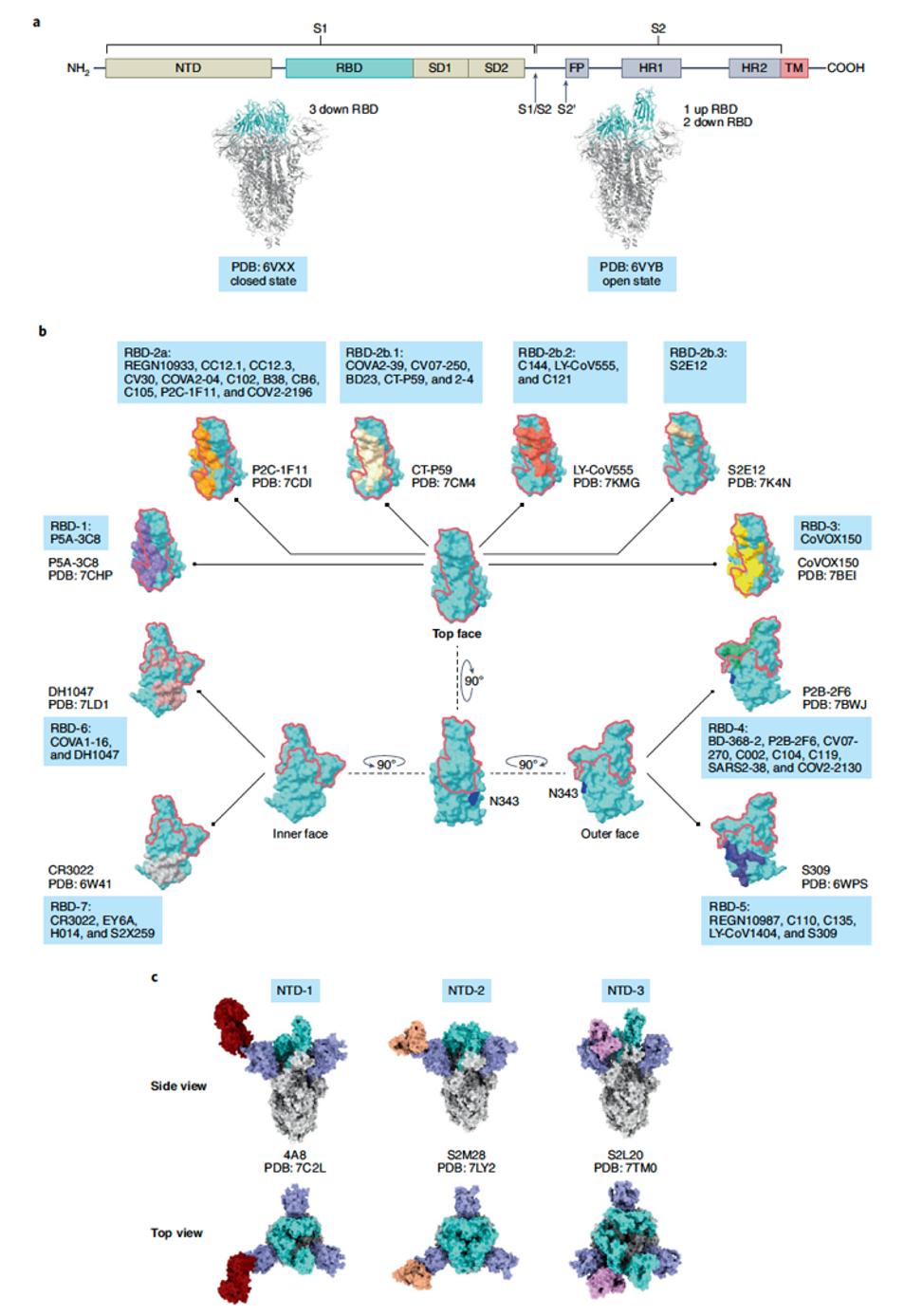
图2. SARS-CoV-2 S蛋白中和抗体特征
综合目前对于SARS-CoV-2抗体反应的认识,祁海教授和张林琦教授指出,目前大多数SARS-CoV-2的疫苗设计开发仅是针对原始毒株,但病毒不断的变异,导致目前疫苗策略对新发变异株的保护能力显著降低,亟需能够诱导广谱中和抗体的通用型疫苗的研发和上市。一方面,补打加强针能够在一定程度上增强和维持机体的抗突变株的广谱中和能力,尤其是序贯异源疫苗接种,能够显著地提高机体内中和抗体的中和能力和广谱能力。另一方面,来自不同变异株的多种抗原集合研究,开发通用型SARS-CoV-2疫苗更能够有助于广谱中和抗体的产生和维持,为构建更强、更广谱和更持久的免疫屏障提供新的策略和思路。
清华大学医学院祁海教授和张林琦教授是本文的共同通讯作者,医学院博士后刘波和生命科学学院王新泉教授做出了重要贡献。相关研究受到了科技部、卫健委、国家自然科学基金委、清华—北大生命科学联合中心、北京市科学技术委员会、北京生物结构前沿研究中心、腾讯基金会和清华大学春风基金等机构的资助支持。
原文链接:
https://www.nature.com/articles/s41590-022-01248-5