近日,清华大学医学院丁强课题组在《mBio》杂志发表题为《Characterization of SARS-CoV-2 variants B.1.617.1 (Kappa), B.1.617.2 (Delta) and B.1.618 by cell entry and immune evasion》的研究论文。该研究发现在新型冠状病毒(SARS-CoV-2)变异株B.1.617.1 (Kappa), B.1.617.2 (Delta)和B.1.618刺突蛋白中出现的突变增强了与不同物种ACE2受体的相互作用,呈现出易感宿主扩大的趋势,并且这些变异株具有逃逸免疫反应的能力。该研究为深入了解变异株的生物学特性提供了重要信息。
目前,由SARS-CoV-2感染引起的新型冠状病毒肺炎(COVID-19)疫情仍然在全球蔓延。随着疫情的持续,新冠病毒基因组也在不断发生变异。德尔塔(Delta, B.1.617.2)、Kappa(B.1.617.1)和B.1.618变异株在印度广泛流行,流行病学调查结果表明,这些变异株的广泛流行和印度疫情的高致死率也有一定的相关性1,2。其中德尔塔变异株已经扩散到全球成为许多区域最主要的变异株,WHO将其列为VOC(variant of concern)变异株之一,其传播速度之快,范围之广令人瞠目结舌3。这些变异株的基因组中,尤其是刺突蛋白(Spike, S)携带多个突变位点(图1),这些突变是导致病毒传播能力以及致病力改变的重要遗传学因素。病毒S蛋白和细胞受体ACE2结合,从而介导病毒进入细胞,该步骤是决定物种易感性的关键步骤,也是治疗性中和抗体以及预防性疫苗发挥作用的重要靶点4,5。因此,变异株传播能力增强的生物学机制是什么,这些突变是否改变了S蛋白对不同物种ACE2的结合能力,以及是否会对疫苗的保护效果造成挑战等重要问题亟待回答。
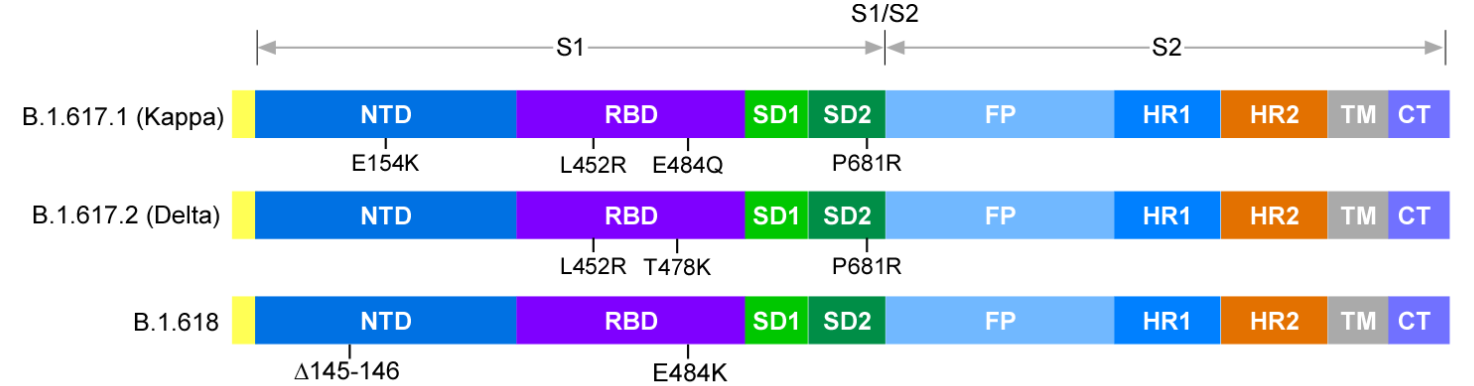
图1.三种新冠变异株在刺突蛋白区域的突变示意图
丁强课题组之前的研究表明,小鼠,考拉和新世界猴的ACE2不能与野生型病毒S蛋白结合支持病毒进入细胞6。研究者首先测试B.1.617.1 (Kappa), B.1.617.2 (Delta)和B.1.618中的突变是否能增强对这些物种ACE2的结合能力。因此,研究人员利用野生型RBD蛋白以及携带以上不同突变的RBD蛋白,分别测定其和人、小鼠、考拉和新世界猴ACE2蛋白的结合能力,结果表明变异株不仅增强了与人ACE2的结合,还获得了和小鼠,考拉和新世界猴ACE2结合的能力,并利用假病毒系统进一步证实了以上结果(图2)。另外,更加细致的功能分析表明,L452R以及E484K突变在介导病毒S蛋白使用小鼠ACE2进入细胞中具有重要的作用。总之,以上实验数据提示,印度变异株可能获得了跨物种传播的能力。
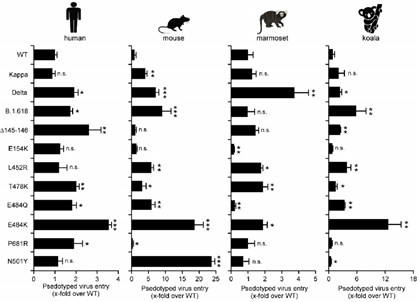
图2.变异株假病毒进入表达不同物种ACE2细胞的能力
SARS-CoV-2进入细胞不仅需要ACE2受体,也需要宿主细胞丝氨酸蛋白酶TMPRSS2切割并激活S蛋白,在S2亚基驱动下,病毒和宿主细胞发生膜融合。因此,研究者分析了变异株S蛋白的切割效率和介导细胞融合的能力。结果表明B.1.617.1 (Kappa)和B.1.617.2 (Delta)变异株的刺突蛋白更容易被切割,且病毒和宿主细胞膜融合的效率显著提高,该生物学性状的改变主要是由刺突蛋白P681R突变所导致。该发现在分子水平上可以部分解释变异株更容易传播的原因。接下来,研究者利用假病毒系统评估B.1.617.1 (Kappa), B.1.617.2 (Delta)和B.1.618对新冠康复者血清中和活性的敏感性,发现这些变异株对康复者血清的中和效果具有不同程度的抵抗(图3),提示变异病毒具备免疫逃逸能力。其中变异株携带的E484Q、T478K、del145-146以及E484K等突变是导致变异株呈现免疫逃逸的关键突变。然而,变异株病毒仍然对重组可溶性人ACE2蛋白的抗病毒活性保持敏感,这与变异株病毒刺突蛋白结合人ACE2受体能力增强的现象吻合,该结果提示重组可溶性ACE2具有广谱的抗病毒活性,是“以不变应万变”应对病毒现有甚至将来变异株的有效方案。
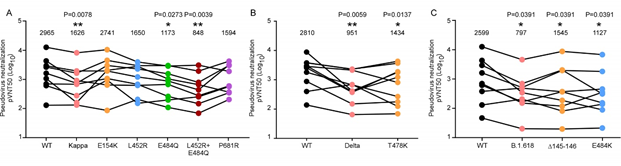
图3.变异株对新冠康复者血清的中和效果具有不同程度的抵抗
该研究认为,Delta为代表的印度变异株与人ACE2受体结合能力增强,且具有更高的细胞膜融合效率,可以更加高效地进入细胞;此外,变异株也获得使用小鼠等其他物种ACE2的能力,具有跨物种传播的潜在风险;另外,变异株病毒也可以不同程度地逃逸人群中已经建立的免疫力,以上三种原因是导致其传播能力增强的重要因素(图4)。
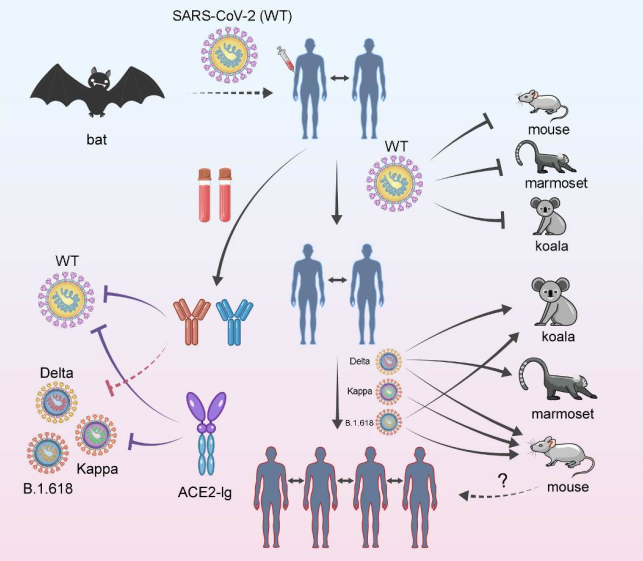
图4.新冠病毒变异株Kappa,Delta和B.1.618在细胞入侵和免疫逃逸等方面的特征
清华大学医学院2018级博士生任文琳、医学院博士后鞠晓辉和2018级博士生龚明丽,生命学院2017级博士生兰君、医学院2020级博士生于晏璎为并列第一作者。清华大学医学院丁强研究员为本文通讯作者。重庆医科大学黄爱龙教授和龙泉鑫研究员、深圳湾实验室钟国才研究员、清华生命学院王新泉教授、复旦大学张荣研究员以及上海巴斯德所钟劲教授等也对该研究提供了指导和帮助。该研究由国家自然科学基金、清华大学春风基金、北京市自然科学基金以及中国科学院武汉国家生物安全实验室高端用户培育项目等资助完成。
参考文献:
1. Cherian S, Potdar V, Jadhav S, et al. SARS-CoV-2 spike mutations, L452R, T478K, E484Q and P681R, in the second wave of COVID-19 in Maharashtra, India[J]. Microorganisms, 2021, 9(7): 1542.
2. Asrani P, Eapen M S, Hassan M I, et al. Implications of the second wave of COVID-19 in India[J]. The Lancet Respiratory Medicine, 2021, 9(9): e93-e94.
3. Mlcochova P, Kemp S A, Dhar M S, et al. SARS-CoV-2 B. 1.617. 2 Delta variant replication and immune evasion[J]. Nature, 2021, 599(7883): 114-119.
4. Lan J, Ge J, Yu J, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor[J].Nature, 2020, 581(7807): 215-220.
5. Wang P, Nair M S, Liu L, et al. Antibody resistance of SARS-CoV-2 variants B. 1.351 and B. 1.1. 7[J].Nature, 2021, 593(7857): 130-135.
6. Liu Y, Hu G, Wang Y, et al. Functional and genetic analysis of viral receptor ACE2 orthologs reveals a broad potential host range of SARS-CoV-2[J].Proceedings of the National Academy of Sciences, 2021, 118(12).
原文链接:https://journals.asm.org/doi/10.1128/mbio.00099-22