精神分裂症(schizophrenia,SZ)是一种具有复杂遗传风险的精神疾病,该疾病是数百种遗传和表观遗传因素之间复杂相互作用的结果。表观遗因素,如组蛋白翻译后修饰,已被证明在许多神经发育过程中发挥关键作用1,2。然而,这些表观遗传机制促成精神分裂症的机制尚不清晰。与此同时,由于我们对精神分裂症的病理生理学和分子基础的了解有限,关于其治疗方法仍然只有部分有效。
2022年4月22日,清华大学医学院李海涛课题组同美国西奈山医学院Ian Maze课题组,Kristen J. Brennand课题组在Nature Communications杂志上共同发表了题为Chromatin profiling in human neurons reveals aberrant roles for histone acetylation and BET family proteins in schizophrenia的文章,该研究利用质谱学方法发现相比较于正常神经元,在精神分裂症患者的神经元中,H2A.Z和H4表现出组合型超乙酰化修饰。随后研究表明BET家族蛋白是H2A.Z乙酰化修饰的“阅读器”,并进一步提供证据表明抑制BET家族蛋白可以改善患者衍生神经元的转录异常。因此,削弱BET蛋白与高乙酰化组蛋白相互作用,可能有助于预防或治疗精神分裂症。

在本研究中,研究者首先利用质谱学手段高通量筛选和探究正常神经元与精神分裂症神经元的组蛋白修饰差异,发现了一种独特的组合型超乙酰化修饰模式,特别发生在H2A.Z变体组蛋白(H2A.Z K4acK7acK11ac)以及组蛋白H4 (H4 K5acK8acK16ac)上。
分子机制层片上,这种超乙酰化修饰对于精神分裂症神经元的功能极有可能是通过组蛋白修饰“阅读器”实现的。众所周知,BET家族蛋白-BRD4是组蛋白H4 K5acK8ac的“阅读器”3,而H2A.Z拥有与H4相似的序列。研究者自然猜想到BRD4可能也是H2A.Z K4acK7acK11ac的“阅读器”。随后的ITC实验证实了研究者的猜想,BRD4包含的两个Bromo结构域均可识别组蛋白H2A.Z K4acK7acK11ac(Bromo1-KD = 2.27 mM;Bromo2-KD = 0.60 mM)。
为了更进一步阐明BRD4识别H2A.Z Kac的分子机制,研究者解析了BRD4-Bromo2与组蛋白多肽H2A.Z K4acK7acK11ac复合物晶体结构。在该结构中,乙酰化修饰的H2A.Z多肽被Bromo结构域的经典识别口袋(由ZA loop和BC loop组成)所识别。其中,K4ac和K7ac插入Asn衬里的疏水口袋中,K4ac锚定在口袋中心,K11ac由于晶体堆积而无法建模。JQ1是BET家族蛋白的经典且与临床相关的抑制。在BRD4中,JQ1可与H2A.ZKac竞争结合口袋,进而抑制BRD4对H2A.Z Kac的识别。在细胞内,ChIP-seq实验结果表明,BRD4与H2A.ZKac具有高度相关性,其在靶基因上展现了几乎相同的共定位特征。而这些BRD4与H2A.ZKac共同富集的靶基因的转录调控,对JQ1抑制BET家族是敏感的。以上,研究者从体外和体内两个层面证实BRD4是组合乙酰化H2A.Z的真正“阅读器”,并表明抑制BET家族蛋白可能部分逆转精神分裂症中组合高乙酰化修饰导致的结果。
文章最后,研究者通过转录组测序实验表明,抑制BET家族可以一定程度上缓解精神分裂症神经元中基因的异常表达。过表达分析显示,尤其缓解其在Tissue expr. Brain,SCZ GWAS,SCZ non-synonymous,BP brain diff. expr.,Psychostimulants for ADHD/ Nootropics和Antipsychotics等相关通路上基因的异常表达。
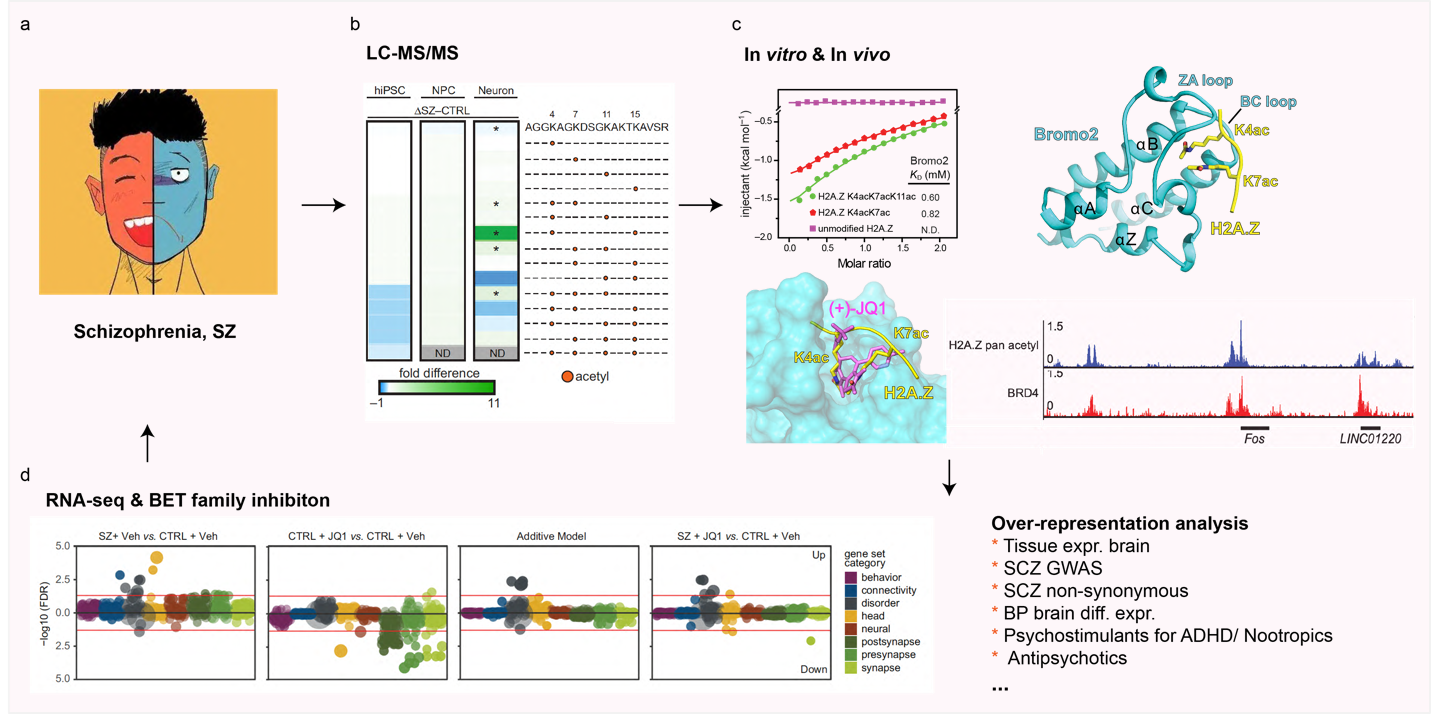
a,精神分裂症;b,质谱学手段鉴定精神分裂症神经元中存在独特的组合型超乙酰化特征;c,ITC实验,Bromo2-H2A.ZKac复合晶体结构以及ChIP-seq实验分别在体内和体外共同证明BRD4是H2A.Z的阅读器;d,RNA-seq数据表明抑制BET家族可以一定程度上缓解精神分裂症神经元中基因的异常表达。(图a来源:百度图片,图b,c和d来源:Nature Communications杂志,本篇文章中)
总的来说,这项工作揭示了精神分裂症的神经元中一种以前未表征的表观遗传现象,该现象可能在疾病病因学中发挥重要作用,并且可用于开发旨在减轻疾病症状的未来疗法。
美国西奈山医学院Ian Maze教授,Kristen Brennand教授和医学院李海涛教授为共同通讯作者。Ian Maze教授实验室Lorna Farrelly博士和李海涛教授实验室郑双平博士(现在美国NIH从事博士后研究)为共同第一作者。本工作得到自然科学基金委国家杰出青年基金与重大研究计划等项目支持。
原文链接:
https://www.nature.com/articles/s41467-022-29922-0.pdf

扫描上方二维码直达原文链接
参考文献:
1.Rajarajan, P. et al. Spatial genome exploration in the context of cognitive and neurological disease.Curr. Opin. Neurobiol.59, 112–119 (2019).
2.Nestler, E. J., Pena, C. J., Kundakovic, M., Mitchell, A. & Akbarian, S. Epigenetic basis of mental illness.Neuroscientist22, 447–463 (2016).
3.Gonzales-Cope, M., Sidoli, S., Bhanu, N. V., Won, K. J. & Garcia, B. A. Histone H4 acetylation and the epigenetic reader Brd4 are critical regulators of pluripotency in embryonic stem cells. BMC Genomics 17, 95 (2016).