2月2日,清华大学医学院李海涛课题组携手普林斯顿大学Tom Muir课题组和西奈山医学院Ian Maze课题组于《美国科学院院刊》(PNAS)在线发表题为“Histone H3Q5 serotonylation stabilizes H3K4 methylation and potentiates its readout”(组蛋白H3Q5五羟色胺化修饰稳定H3K4甲基化修饰并强化其识别)的研究论文,报道了组蛋白H3Q5五羟色胺化修饰(H3Q5ser)对于转录起始标志H3K4三甲基化(H3K4me3)修饰的影响。该研究发现H3Q5Ser不影响邻近H3K4me3的酶促产生,可促进H3K4me3下游阅读器的识别,但抑制了H3K4me3的酶促消除,从而稳定H3K4me3修饰并强化其基因活化功能。
五羟色胺,又称血清素(serotonin),是一类神经递质,对情绪等神经生物学事件有重要的调控作用。五羟色胺广泛存在于哺乳动物组织中,除中枢神经组织外,其主要外周产生部位是胃肠道,约90%合成和分布于肠嗜铬细胞。Ian Maze课题组曾于2019年在Nature杂志发表论文,首次报道了H3Q5ser修饰的存在,以及“H3K4me3Q5ser”修饰组合对基因表达和神经发育的影响(Nature,2019,567:535–539)。该工作把五羟色胺这一内源生物活性小分子与表观遗传修饰调控联系了起来,启示了营养代谢除为细胞活动提供物质、能量和信号之外的“信息”功能。由于H3Q5紧邻H3K4位点,因此H3Q5ser修饰很可能对H3K4me3修饰的催化和识别产生影响。在本项工作中,研究者详细探究了H3Q5ser修饰与H3K4me3修饰的交叉会话(crosstalk)机制。
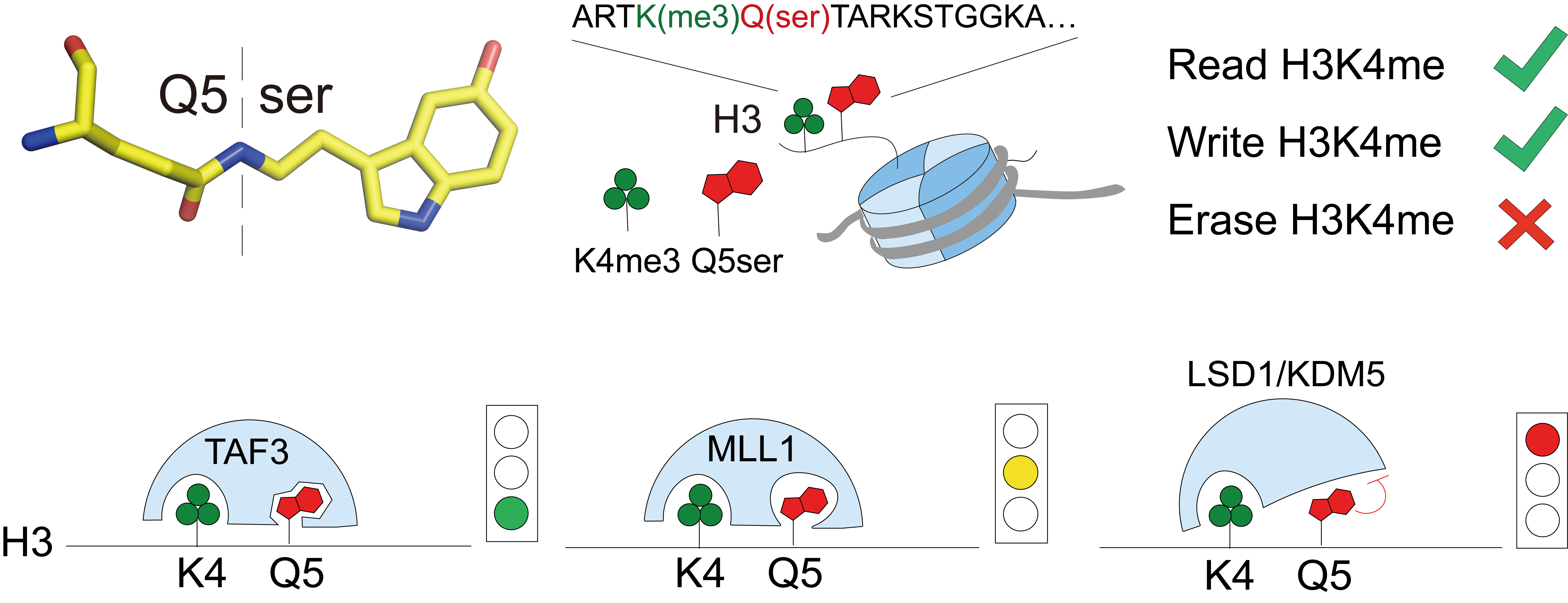
组蛋白H3Q5ser稳定H3K4me3修饰并强化其功能
首先,研究人员利用表面等离子体共振成像(SPRi)技术,对目前已知的代表性H3K4me3阅读器(如BPTF,CHD1,DIDO1,ING2,KDM5A,KDM4A,MLL5,PHF13,PHF2,RAG2,SET3,SGF29,SPIN1,TAF3,和ZCWPW1),进行了基于蛋白质芯片阵列的互作表征。研究发现,组蛋白H3Q5ser修饰并不会打破这些下游效应因子对于H3K4me3修饰的识别。其中,对于TAF3的PHD结构域来说,无论K4的甲基化状态如何(K4me0,K4me1,K4me2,K4me3),H3Q5ser修饰都可以增强结合强度,甚至达到9倍。如果将五羟色胺化修饰替换五羟色胺的类似物(如H3Q5(tryptamine),H3Q5(5-methoxytryptamine,H3Q5(7-azatryptamine), H3Q5(6-hydroxytryptamine)),则会不同程度地削弱与TAF3的结合。这表明组蛋白同TAF3结合强度的增强是五羟色胺修饰依赖的。
对于H3K4me3修饰因子MLL1甲基转移酶复合物来讲,H3Q5ser修饰不会对其活性产生明显影响。更进一步的酶反应动力学分析发现,H3Q5ser修饰对于MLL1催化H3K4me0到H3K4me1没有影响,对于催化H3K4me1到H3K4me2有轻微的抑制作用。因此,总体来讲H3Q5ser修饰对于MLL1复合物的酶活没有产生明显的影响。
有趣的是,对于H3K4me3的酶促消除而言,由于存在空间位阻效应,H3Q5ser修饰可以完全打破H3K4去甲基化酶KDM5和LSD1的活性。在多肽和重构染色质水平的实验都表明H3Q5ser修饰可以使LSD1及KDM5无法催化H3K4me3的去甲基化反应。进一步的重构染色质水平的酶活实验表明H3Q5ser修饰影响了KDM5催化结构域的活性而非PHD结构域的结合能力。值得一提的是,KDM5家族成员通过负调控增强子与启动子区H3K4me3水平,发挥着转录抑制分子功能,在肿瘤转录异质性调控、肿瘤免疫逃逸、肠道微生物组稳态调节、神经系统发育等过程中发挥着重要作用。本研究所揭示的H3Q5ser修饰对KDM5的拮抗作用对于进一步理解KDM5去甲基化酶的生理功能与调控提供了新视角。
组蛋白修饰交叉会话是一类重要的表观调控机制,在表观景观建立和基因开关切换等细胞进程中扮演着重要角色,彰显了表观调控的层次性和精密性。李海涛课题组与Josefowicz课题组合作,曾在去年报道组蛋白H3.3S31ph修饰同H3.3K36me3之间的交叉会话(Nature, 2020, 583:852-857),揭示出H3.3S31ph通过强化H3.3K36me3的转录延伸功能,实现刺激诱导型基因的快速转录延伸。在本工作中,研究人员揭示了H3Q5ser对转录起始标志性修饰H3K4me3的调制作用,即在H3Q5ser存在情况下,H3K4me3无法被“擦除器”(eraser)有效去除,而H3K4me3“阅读器”(reader)如TAF3却可以被更有效的招募,提示H3Q5ser可以通过强化H3K4me3的功能,实现H3K4me3靶基因的转录起始活化。越来越多的研究表明,类似H3K4me3和H3K36me3等甲基化修饰单独不足以代表基因的激活表达,通过产生H3Q5ser和H3.3S31ph等邻近修饰而拮抗负调控因子的沉默作用,对于完全释放H3K4me3和H3K36me3修饰的转录激活功能发挥着重要正向调控作用。
清华大学医学院李海涛课题组赵帅、张柏超博士和普林斯顿大学Tom Muir课题组Kelly N. Chuh博士为共同第一作者;李海涛教授,Tom Muir教授和Ian Maze副教授为共同通讯作者。清华大学生命学院刘晓蕙、徐宁、薛毅老师对本工作开展做出了重要技术指导和支持。该课题得到了自然科学基金委和科技部重点研发计划的基金支持。
论文链接:
https://www.pnas.org/content/pnas/118/6/e2016742118.full.pdf

扫描上方二维码直达原文