2020年7月23日,《自然》杂志正式发表医学院李海涛课题组和耶鲁大学萧琢(Andrew Z. Xiao)实验室题为“N6-methyladenine in DNA antagonizes SATB1 in early development”(DNA N6-甲基腺嘌呤(6mA)在早期发育过程中拮抗SATB1)的合作文章。该论文发现DNA 6mA修饰可以拮抗基因组组织蛋白SATB1在SIDD(压力诱导的DNA双螺旋失稳)区结合,从而调控染色质结构并影响早期胚胎发育。
图1 DNA 6mA修饰拮抗SATB1调节早期发育
6mA修饰是近年来在哺乳动物基因组中鉴定出的新型DNA甲基化修饰,被称为基因组第九碱基,但其丰度、分布和产生方式等在领域内仍存争议,亟需深入细致的机制性研究突破。
2016年,耶鲁大学干细胞中心的萧琢教授首次在Alkbh1缺陷型小鼠胚胎干细胞中鉴定出DNA 6mA的存在,并发现其对转座元件如LINE-1的表观沉默功能(Wu et al,Nature 2016)。2018年,萧琢实验室与加利福尼亚大学圣迭戈分校(UCSD)的Jeremy Rich实验室合作发现人类神经胶质瘤干细胞基因组中有着丰富的6mA修饰,参与癌症的发展,因此靶向ALKBH1有望成为治疗神经胶质瘤新策略 (Xie et al,Cell 2018)。李海涛课题组与萧琢实验室自2015年就开始了6mA修饰相关的合作研究。历经数年积累,今年年初在我国自己主办的高影响力学术杂志《细胞研究》(Zhang et al,Cell Res 2020)发表合作论文,通过系统的生化和复合物结构解析,发现ALKBH1偏好催化“鼓泡”状态的DNA 6mA修饰,首次揭示哺乳动物基因组6mA酶促消除的分子基础。
基因组容易发生局部开链的“鼓泡”区域正是AT富集的SIDD区域。该区域富含核基质附着区(matrix attachment regions,MARs) DNA基序(motif),可通过介导基因组与核基质的相互作用,参与染色质高维结构组织,对转录、复制等过程有着重要调控作用。在这一过程中,围绕6mA修饰的识别与催化事件发挥什么作用?其在早期胚胎发育过程中有何功能?《自然》发表的本项工作即围绕这些科学问题展开。
由于6mA在小鼠胚胎干细胞(mES)中丰度较低(百万分之6-7),研究者首先寻找适宜的细胞培养条件来提高6mA含量。值得注意的是,在四倍体补偿实验(tetraploid complementation,4N)中,6mA丰度与不同培养条件下mES的发育潜力呈正比。也就是说,在传统的2i(加入ERF和GSK3b抑制剂)条件中(4N阴性),6mA水平显著降低;而在其他2i条件下(4N阳性),6mA的水平则得以保留。mES细胞培养条件的差异可能是造成不同课题组关于6mA丰度争议的原因。mES的发育潜力与其细胞重编程状态密切相关,这也提示了6mA在早期发育过程中的重要作用。
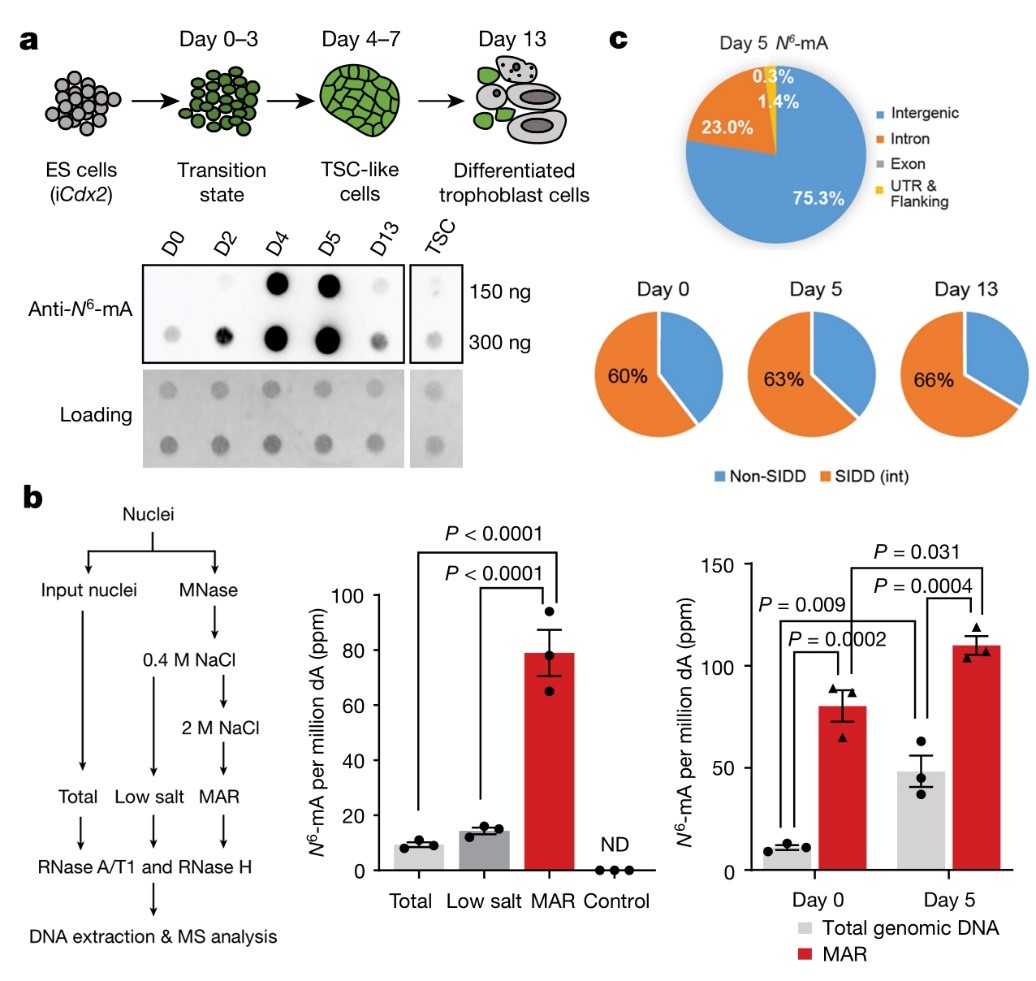
图2 基因组6mA的动态调节及其SIDD分布
随后,研究者利用胚内向胚外组织的干细胞转分化系统,发现6mA丰度在小鼠滋养层干细胞(trophoblast stem cell,TSC)形成过程中有明显升高,随后下降(图2a)。更有意思的是,作者发现6mA在基因组分布不是随机的。通过MAR DNA抽提和质谱鉴定发现6mA修饰富集在核基质附着区DNA,且在转分化进程第5天明显上调(图2b)。进一步的DNA免疫共沉淀测序(DIP-seq)发现6mA主要位于AT含量高的基因间区域(intergenic regions),比如转座子LINE-1s;特别地,进一步分析显示超过60%的6mA位于SIDD区(图2c)。SIDD区有助于推动拓扑压力诱导的DNA双螺旋不稳定,对染色质结构的组织有重要作用,包括建立和维持异染色质-常染色质边界和DNA的长距离互作等。其中SATB1是SIDD调节蛋白,可以直接结合MAR基序组织染色质高级结构。
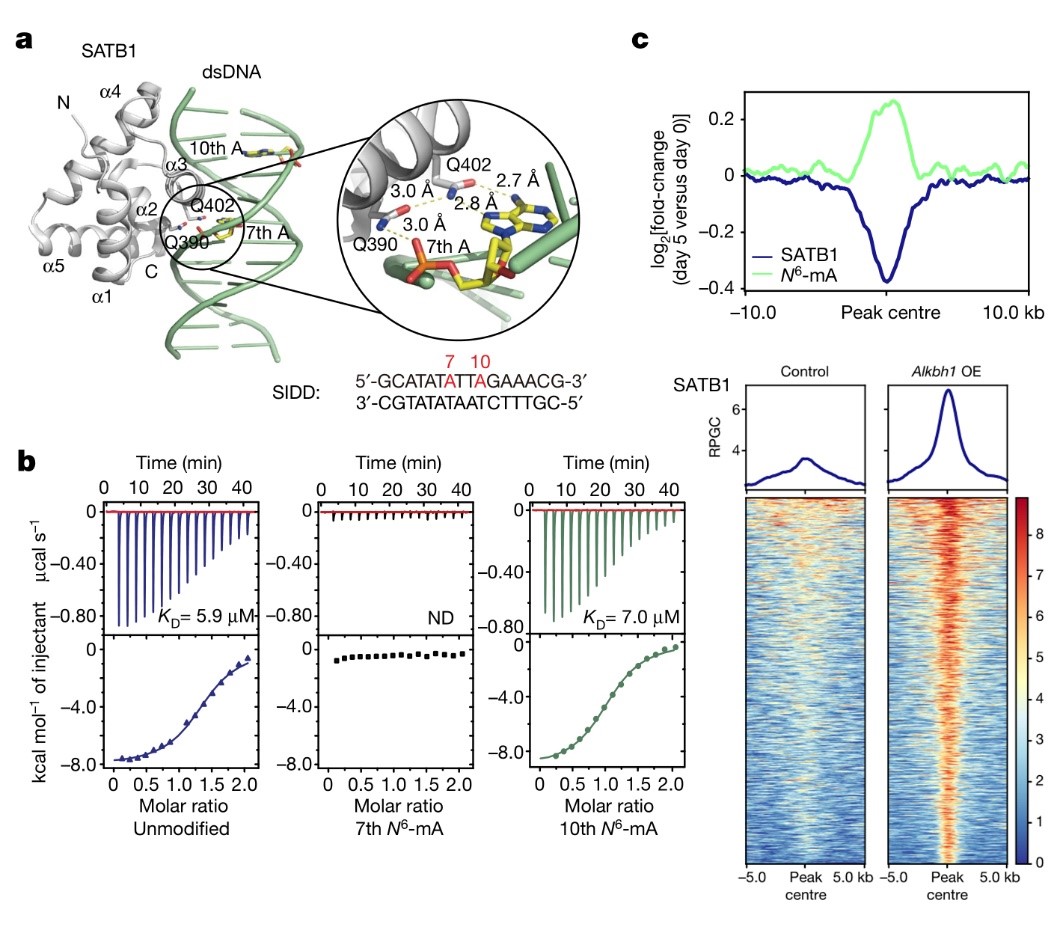
图3 基因组6mA拮抗SATB1结合
那么,6mA是否会影响调节蛋白,比如SATB1,在SIDD区的结合呢?确实,结构分析与结合实验显示在体外条件下,6mA都能显著的阻碍SATB1对DNA的结合(图3a,3b)。ChIP-seq数据分析表明,SATB1的基因组定位与6mA的基因组分布呈现互斥关系(图3c),而过表达6mA去甲基化酶ALKBH1后可以显著上调SATB1基因组定位。随后研究者利用ATAC-seq手段探讨染色质开放程度与6mA修饰的关系。结果发现6mA修饰降低位点的染色质变得更加开放,异染色质区域也被打开。Alkbh1过表达后染色质可及区域则会蔓延过6mA修饰所在的边界。同时体内实验证明过表达活性Alkbh1而非酶活缺陷Alkbh1可以促进滋养层巨细胞(trophoblast giant cell,TGC)的形成。这说明6mA通过拮抗SATB1维持染色质的常染色质-异染色质边界,调控周边基因的表达,进而影响TSC的形成。
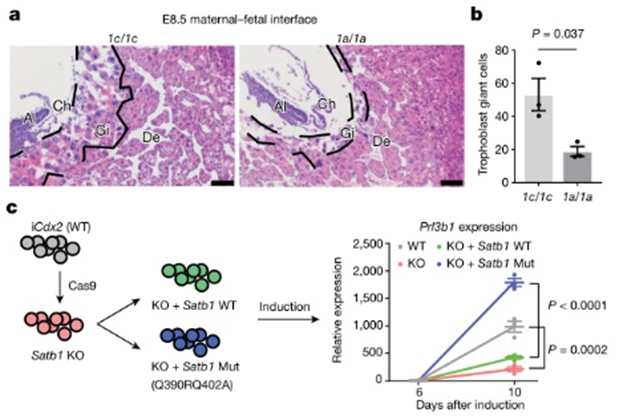
图4 6mA调控小鼠早期胚胎发育
为进一步研究6mA在胚胎发育中的功能,研究者构建了ALKBH1缺失的小鼠。虽然ALKBH1缺失的杂合小鼠可以出生,但是纯和小鼠却不能。ALKBH1缺失会增加胎盘组织6mA修饰水平并抑制TSC向TGC的分化,显著减少TGC形成(图4a,4b)。同时,SATB1的敲除也有与ALKBH1缺失相似的表型,该表型可以被野生型SATB1回补,同时更能被容忍6mA修饰的SATB1改造突变体有效回补(图4c),说明6mA主要通过拮抗SATB1结合发挥功能。
总的来说,该研究发现6mA通过拮抗SATB1在发育的早期调节染色质结构,为研究表观遗传修饰调控染色质结构和基因表达提供了新的思路,具有重要意义。
清华大学李海涛教授与耶鲁大学萧琢教授为文章共同通讯作者,李海涛教授实验室已毕业学生赵帅博士为文章的共同第一作者,李海涛教授实验室张敏博士参与了本项工作。本项目得到了国家自然科学基金委员会,科技部重大研究计划,北京结构生物学高精尖创新中心,北京生物结构前沿研究中心,以及清华-北大生命科学联合中心的支持。
原文链接:
https://www.nature.com/articles/s41586-020-2500-9