2020年2月12日,清华大学医学院李海涛研究组在Cell Research期刊以长文形式报道了题为“哺乳动物ALKBH1是一类非配对DNA的N6-甲基腺嘌呤去甲基化酶” (Mammalian ALKBH1 serves as an N6-mA demethylase of unpairing DNA)的研究论文。该研究通过建立稳定可靠的体外酶活检测体系,首次鉴定出ALKBH1为一类局部非配对DNA的N6-甲基腺嘌呤(6mA)去甲基化酶(图1);首次解析了ALKBH1自由态以及与DNA底物的复合物结构,揭示了ALKBH1偏好局部非配对核酸底物的结构基础,为哺乳动物基因组第九碱基6mA的调控生物学提供了全新的研究视角。
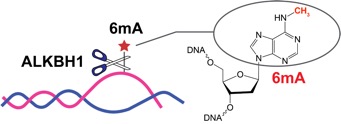
图1 ALKBH1偏好局部开链DNA并催化6mA的去甲基化
6mA是哺乳动物基因组中除5甲基胞嘧啶及其衍生物(5mC,5hmC,5fC,5caC)之外的又一类表观修饰,被称为哺乳动物基因组第九碱基。基因组6mA的水平在早期胚胎发育和癌症发生等过程中呈现出剧烈波动,其背后的调控机制是解码这一新型修饰碱基生物学功能的关键。本研究合作者耶鲁大学Andrew Xiao教授实验室曾在2016年在Nature发文首次报道ALKBH1具有DNA 6mA的去甲基化酶活力。但自1996年ALKBH1被克隆以来,其生理底物一直存在巨大争议,相关结构亦未解析,亟待进一步研究。
ALKBH1是Fe(II)-α-酮戊二酸双加氧酶超家族中AlkB家族的成员,与5mC去甲基化酶Tet家族存在很近的亲缘关系。在本研究中,研究者首先建立了基于液相-质谱(LC-MS/MS)的定量酶活检测体系,系统地检测了ALKBH1对各类核酸底物的去甲基化酶活,发现ALKBH1偏好催化局部开链的鼓泡DNA而非单链DNA中6mA的去甲基化,且完全无法催化双链底物的去甲基化(图2);进一步实验表明,ALKBH1可以同样高效催化多种局部非配对核酸(如bulge、R-loop、D-loop和stem loop等)中6mA的去甲基化,而对碱基序列没有特别偏好,首次阐明了ALKBH1对底物二级结构的高度依赖性。同时,研究者建立的基于寡链核酸的质谱测活方法,成功捕获了6mA去甲基化过程的中间产物N6-羟甲基腺嘌呤(6hmA),为ALKBH1催化的化学机理提供了新证据。6hmA在非酶促条件下,可以稳定存在数小时,提示6hmA有可能作为一种亚稳态表观修饰参与调控。
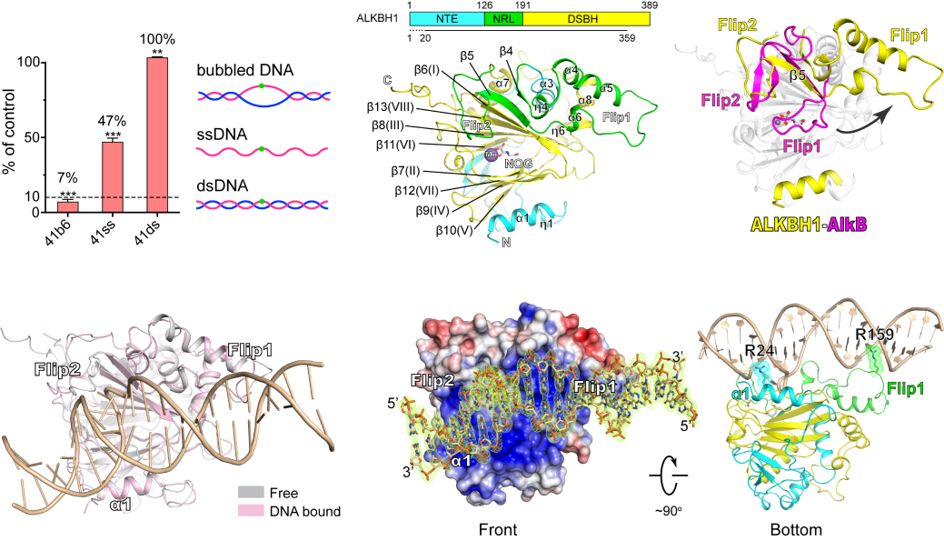
图2 ALKBH1识别与催化非配对DNA 6mA去甲基化的生化结构基础
其它AlkB家族成员以及Tet家族成员均未表现出对局部非配对核酸的偏好,那么ALKBH1这种独特底物偏好的结构基础是什么呢?如图2所示,ALKBH1由位于C端的催化结构域(DSBH)、相邻的底物识别亚结构域(NRL)以及N端的延长区域(NTE)构成,其中NRL亚结构域又细分为Flip1和Flip2两部分。研究者首先解析了2.5 Å的ALKBH1自由态结构,发现其Flip1远离酶活中心且外翻伸展,这与其它AlkB家族成员以及Tet2“回扣式”的Flip1构象形成了鲜明反差。已有研究表明,“回扣式”Flip1构象对于稳定双链DNA修饰碱基外翻,促使其伸向活性中心完成催化有着重要作用。ALKBH1中Flip1的伸展构象导致其失去了自主外翻DNA碱基的能力,因此ALKBH1无法催化双链DNA底物,而其酶活发挥需要碱基的预先翻转。
随后,研究者通过定点交联策略,使原本结合较弱的ALKBH1和凸起DNA底物形成稳定、均一的复合物,并最终在2.4 Å分辨率水平解析了复合物晶体结构(图2)。结果表明, ALKBH1伸展的Flip1与其N端的α1位于催化中心两侧,分别与翻转碱基左右两侧的双链区域互作。其中,α1和Flip1上的R24和R159残基分别以“精氨酸手指”方式插入双链区域的小沟中,协助将DNA凸起中外翻的修饰碱基呈递至催化中心实现去甲基化。复合物结构解析突显了局部非配对底物双链区在ALKBH1底物识别过程中的关键作用,阐明了ALKBH1偏好催化局部开链核酸底物而非单链底物的原因。研究者进一步对小鼠早期胚胎发育细胞进行DIP-seq以及ssDNA-seq分析,发现N6-mA与基因组的非配对区域存在着显著的共定位,暗示着N6-mA的调控可能与真核生物染色体高级结构的动态变化密切相关,这将为后续ALKBH1以及N6-mA的功能研究提供全新的视角。
清华大学李海涛教授和耶鲁大学Andrew Xiao教授为共同通讯作者。李海涛实验室张敏博士(清华-北京生命科学联合中心2015级博士研究生)、医学院博士研究生杨舒敏以及耶鲁大学博士研究生Raman Nelakanti为本文共同第一作者。第二作者2018级PTN联合项目博士生赵文涛同学和清华大学代谢质谱平台的刘晓蕙老师为本工作的顺利开展作出了重要贡献。
本工作得到国家自然科学基金委员会、科技部重点研发计划、清华-北京生命科学联合中心、北京市结构生物学高精尖创新中心、北京生物结构前沿研究中心等机构的经费支持。本课题得到上海同步辐射光源、清华大学X-ray晶体学平台以及代谢质谱平台的大力支持与协助。
论文链接:https://doi.org/10.1038/s41422-019-0237-5